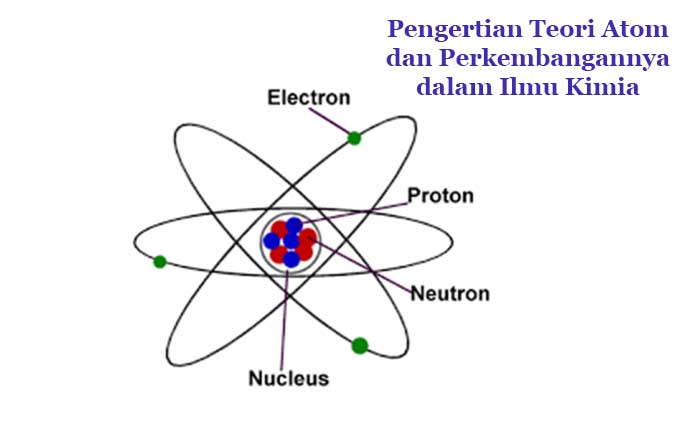
Atom merupakan partikel terkecil yang menyusun segala materi yang ada di dalam kehidupan dan berada di sekitar kita, baik di sadari ataupun tidak. Faktanya memang semua organisme juga tersusun oleh atom sehingga kita tidak akan terlepas dari yang namanya atom.
Telah banyak perkembangan dan penerapan ilmu kimia mengenai teori atom dari sejarah pertama kali ditemukan hingga saat ini.
Atom
Dalam sifat kimia dan fisika, teori atom merupakan teori ilmiah tentang sifat dasar materi yang menyatakan bahwa materi terdiri dari unit diskrit dan terkecil yang disebut atom. Kata atom berasal dari bahasa Yunani kuno yang berarti tak terpisahkan. Pada abad ke 19 para ahli kimia mulai menggunakan istilah ini sehubungan dengan semakin besarnya perkembangan ilmu mengenai atom ini.
Teori atom berisi deskripsi ilmiah tentang sifat atom dan materi yang menggabungkan unsur fisika, kimia dan matematika. Menurut teori modern, suatu materi terbuat dari partikel terkecil yang disebut atom. Atom dari unsur yang identik berbeda dengan atom lainnya sehingga memiliki sifat yang unik. Atom dapat bergabung dalam proporsi yang tetap dengan atom lain untuk membentuk molekul dan senyawa.
Teori Atom
Berdasarkan perkembangannya semenjak pertama kali dikemukakan, teori atom telah mengalami banyak perubahan dan perkembangan. Akan tetapi yang pasti atom menjadi unit terkecil dari materi yang membentuk unsur kimia.
Dimana setiap padatan, cairan, gas, dan plasma terdiri dari atom netral atau terionisasi. Atom sangat kecil, biasanya berukuran sekitar 100 pikometer.
Jenis Teori Atom Menurut Para Ahli
Berikut ini merupakan beberapa model teori atom yang telah dikemukakan oleh para ahli dan memiliki pengaruh dalam ilmu kimia modern saat ini. Antara lain;
-
Dalton

Butuh hingga akhir abad ke 18 bagi para ilmuwan untuk memberikan bukti tentang keberadaan atom. John Dalton diantara para ilmuwan lain mengembangkan hukum proporsi berganda yang menyatakan bahwa rasio massa unsur dalam suatu senyawa adalah bilangan bulat sederhana.
Dalton juga menyuarakan teori atomnya yang didalamnya menyatakan bahwa atom merupakan materi yang tersusun dari suatu inti dan dikelilingi elektron yang bermuatan negatif. Dalton menggambarkan sebuah atom sebagai suatu bola pejal.
Berikut ini beberapa pendapat Dalton mengenai teori atom;
- Atom merupakan unit terkecil dari suatu materi yang sudah tidak bisa dibagi
- Atom dapat digambarkan seperti bola pejal dengan ukuran kecil dimana satu unsur mempunyai atom yang identik dengan unsur yang sama namun berbeda dengan unsur yang lain
- Suatu atom dapat bergabung untuk membentuk molekul atau senyawa dengan rasio bilangan bulat sederhana
- Atom tidak dapat diubah menjadi jenis atom lain, atom tidak dapat diciptakan maupun dimusnahkan dalam suatu proses reaksi kimia
Teori atom dalton ini memiliki kelebihan karena teori ini mampu menjelaskan mengenai hukum kombinasi kimia melalui hukum proporsi berganda yang diungkapkan oleh Dalton. Namun teori Dalton juga memiliki kelemahan seperti tidak mampunya menjelaskan tentang alotrop dimana perbedaan sifat antara berlian, grafit dan arang tidak mampu dijelaskan.
Meskipun demikian, teori yang dikemukakan oleh Dalton memiliki dampak yang sangat baik untuk perkembangan ilmu kimia karena setelah pendapatnya, terdapat perkembangan yang begitu pesat tentang teori atom ini.
-
Thomson

Setelah penemuan elektron oleh J.J. Thomson pada tahun 1897, orang-orang kemudian menyadari bahwa ternyata atom bukan partikel terkecil melainkan masih terdapat partikel yang lebih kecil dari atom. Oleh karena itu, Thomson mengusulkan teori atom dengan pernyataannya bahwa atom memiliki bentuk seperti roti kismis.
Roti kismis yang dimaksud Thomson adalah penggambaran untuk sebuah atom yang bermuatan positif yang dikelilingi partikel negatif seperti roti yang dikelilingi kismis yang menyebar di sekelilingnya.
Berikut ini pendapat J.J. Thomson mengenai teori atomnya:
- Atom merupakan suatu bola yang memiliki muatan positif dengan dikelilingi oleh elektron yang bermuatan negatif disekelilingnya
- Dalam satu atom, jumlah partikel positif dan negatif memiliki muatan yang sama sehingga membuat satu atom tersebut tidak bermuatan atau bermuatan netral
J.J. Thomson mengemukakan teorinya setelah melakukan eksperimen dengan suatu tabung sinar katoda dimana pada saat menembakkannya terdapat pembelokan ke arah plat tertentu yang kemudian membuktikan bahwa pembelokan partikel tersebut disebabkan oleh partikel yang bermuatan negatif dalam suatu atom.
Kelebihan dari teori atom Thomson yaitu teori ini mampu menjelaskan tentang adanya partikel yang lebih kecil dari ukuran atom dan mampu menerangkan sifat kelistrikan dalam suatu atom.
Namun teori atom Thomson tidak mampu menjelaskan tentang penghaburan sinar alfa oleh material emas yang dilakukan oleh Rutherford dan teori ini juga tidak menjelaskan tentang inti atom karena muatan positif berposisi tidak di tengah melainkan tersebar di seluruh atom.
-
Rutherford

Rutherford melakukan beberapa percobaan yang menyebabkan perubahan tentang teori atom yang telah ada. Rutherford melakukan eksperimen dengan menembak suatu atom lempeng emas tipis dengan suatu sinar alfa dari unsur radioaktif.
Hasil yang didapatkan, sinar alfa tersebut ternyata mengalami beberapa hal seperti pemantulan, pembelokan, dan ada sinar yang diteruskan setelah melalui lempeng emas. Hal itu membuat Rutherford melakukan penelitian lebih lanjut mengenai hamburan sinar alfa dalam lempeng emas yang menghasilkan teori atom baru.
Model baru dari rutherford ini menggambarkan atom sebagai sesuatu yang tersusun dari partikel sebagai inti kecil yang padat dan bermuatan positif serta dikelilingi oleh elektron yang bermassa lebih ringan dan bermuatan negatif. Beberapa hal yang diungkapkan oleh Rutherford mengenai teori atomnya:
- Sebagian besar dari suatu atom adalah berupa ruang kosong atau ruang hampa
- Suatu atom mengandung inti atom yang memiliki muatan positif dan merupakan pusat massa dari atom itu sendiri
- Elektron mengelilingi inti tersebut dan bergerak dengan kecepatan tinggi
- Sinar alfa yang diteruskan tanpa mengalami pembelokan disebabkan karena ruang hampa dalam atom, sebagian kecil sinar lainnya dibelokkan dan dipantulkan karena mengalami tumbukan dengan partikel elektron
- Awan elektron ternyata tidak berpengaruh dalam hamburan sinar alfa
Jenis teori atom Rutherford ini memiliki beberapa kelebihan seperti mampu menjelaskan struktur atom yang pada dasarnya rumit menjadi lebih mudah untuk dipahami, Rutherford juga mampu menjelaskan tentang bagaimana lintasan elektron yang mengelilingi inti dalam satu atom serta mampu menggambarkan gerak elektron tersebut.
Namun, teori Rutherford berlawanan dengan hukum fisika klasik dimana ketika elektron bergerak dengan memancarkan sejumlah energi tertentu maka elektron akan kehabisan energi dan berhenti bergerak. Selain itu, Rutherford juga tidak mampu menjelaskan secara detail letak elektron dan rotasinya.
-
Bohr

Untuk mengembangkan teori dalam bentuk partikel atom Rutherford, Niels Bohr melakukan penelitian tentang pengaruh spektrum garis pada atom yang menunjukkan bahwa elektron dalam satu atom hanya berada pada lintasan dengan tingkat energi tertentu.
Bohr mengemukakan dua usulan yang menjelaskan tentang kestabilan suatu atom:
- Orbit atau kulit merupakan lintasan stasioner yang digunakan oleh elektron untuk mengelilingi suatu inti atom. Meskipun gerakan elektron sangat cepat dalam berputar, namun elektron tidak dapat melepas atau menyerap energi sehingga gerakan dan energi elektron selalu tetap dan tidak akan berhenti ataupun jatuh ke inti.
- Dalam satu atom, suatu elektron dapat mengalami perpindahan dari satu kulit atau lintasan ke kulit yang lain dengan menyerap atau melepaskan energi. Ketika elektron berpindah kulit maka energi yang diserap atau dilepas tersebut dinamakan energi foton.
Untuk mempermudah pemahaman mengenai teori atom Bohr ini kita dapat menggambarkannya seperti satu sistem tata surya.
Semua planet sebagai elektron bergerak berputar mengelilingi matahari sebagai inti dimana setiap planet memiliki orbit atau lintasan sendiri seperti halnya elektron. Berdasarkan teori atom Bohr ini juga diperkenalkan konfigurasi elektron yang merupakan susunan elektron dalam suatu atom yang menjelaskan tentang letak atau posisi elektron dengan orbitalnya.
Teori atom Borh memiliki kelebihan yaitu dapat menjelaskan tentang kulit atau subkulit tempat orbit elektron dan dapat berpindah dari satu orbit ke orbit lain. Namun Bohr hanya mampu menjelaskan tentang atom hidrogen dan tidak dapat menjelaskan tentang atom yang lebih rumit.
Hingga saat ini, keempat teori tersebut merupakan beberapa perubahan besar yang ada dalam ilmu kimia. Meskipun banyak pendapat mengenai teori atom yang lain, namun 4 teori diatas yang merupakan pelopor dalam teori atom yang ada hingga saat ini.
Saat ini teori atom juga telah mengalami banyak penyempurnaan sehingga kimia modern telah terbentuk dengan teori atom tersebut.
Demikianlah artikel yang dapat dituliskan terkait dengan jenis dan perkembangan teori atom yang telah dikemukakan oleh para ahli. Semoga melalui tulisan ini bisa memberikan wawasan serta menambah pengetahuan bagi segenap pembaca sekalian.