Laju reaksi menjadi suatu kajian penerapan kimia secara kinetika dalam serangkaian reaksi kimia yang terjadi. Dalam ilmu kimia, laju reaksi ini penting karena sangat menentukan bagaimana suatu reaksi itu terjadi.
Bahkan disadari maupun tidak dengan ilmu kinetika kimia ini kita dapat mendesain reaksi yang memiliki efisiensi dan efektivitas tinggi sehingga akan menguntungkan, prinsip ini banyak diterapkan pada kimia industri yang melibatkan reaksi dalam jumlah besar sehingga penentuan mengenai laju reaksi sangat penting untuk diperhitungkan dengan tujuan meningkatkan produktivitas.
Laju Reaksi
Yang perlu diketahui, bahasan terkait dengan cabang ilmu kimia yang mempelajari secara mendalam terkait laju reaksi dan mekanismenya disebut kinetika kimia. Dimana dengan memahami disiplin ilmu ini kita dapat mempelajari tentang bagaimana suatu reaksi berlangsung dan apa saja yang mempengaruhinya.
Pengertian Laju Reaksi
Laju reaksi adalah kecepatan suatu arti reaksi kimia dapat berlangsung, hal ini dapat dinyatakan dalam konsentrasi suatu produk yang terbentuk dalam satu satuan waktu atau dapat juga dikatakan sebagai jumlah reaktan yang dikonsumsi dalam satu satuan waktu tertentu.
Terlihat bahwa jika suatu reaksi memiliki laju reaksi yang rendah, maka molekul-molekul reaktan tersebut saling bergabung dalam kecepatan yang lambat. Di dunia ini laju reaksi sangat beragam, ada reaksi yang membutuhkan waktu yang sangat cepat dibawah 1 detik bahkan hingga tingkat femtosecond (1 x 10-15 detik) sehingga tidak dapat diamati dengan mata telanjang karena perubahan yang sangat cepat, namun ada juga reaksi yang membutuhkan waktu sangat lama hingga ribuan tahun seperti pada reaksi pembentukan bentuk hidrokarbon minyak bumi dari fosil.
Pengertian Laju Reaksi Menurut Para Ahli
Adapun untuk definisi laju reaksi menurut para ahli, antara lain;
- Chang (2005), Laju reaksi adalah materi penghitungan kecepatan yang menunjukkan persatuan waktu dalam jumlah pereaksi dan hasil reaksi yang dipengaruhi oleh konsentrasi molar.
- Keenan (1984), Definisi laju reaksi adalah tahapan terkait berkurangnya konsentrasi suatu pereaksi dalam penghitungan kimia terkait dengan materi produk tertentu.
Teori Laju Reaksi
Isi teori dalam materi laju reaksi ini juga berhubungan dengan penghitungan terkait dengan bagaimana suatu zat itu dapat bereaksi satu sama lain yaitu tentang teori tumbukan. Suatu partikel reaktan dapat terjadi reaksi karena mengalami peristiwa tumbukan dengan partikel yang lain sehingga terjadi penggabungan.
Semakin banyak tumbukan yang terjadi dalam suatu sistem, maka akan lebih banyak terjadi kombinasi atau penggabungan molekul. Jika ada lebih banyak hal tersebut terjadi maka ada kemungkinan bahwa molekul tersebut akan lebih cepat dalam menyelesaikan suatu reaksi atau dengan kata lain kecepatan reaksinya tinggi.
Rumus Penghitungan Persamaan Laju Reaksi
Laju reaksi berhubungan dengan suatu zat yang berubah dalam satu satuan waktu. Maka hal ini dapat dituliskan melalui persamaan laju reaksi:

Seperti definisinya bahwa laju reaksi jika ditinjau dari produk adalah jumlah produk yang terbentuk dalam satu satuan waktu, sedangkan jika ditinjau dari reaktan adalah jumlah reaktan yang dikonsumsi dalam satu satuan waktu. Jika dicontohkan adalah reaksi antara A dan B untuk membentuk C:

Tanda negatif yang diberikan pada A dan B menunjukkan bahwa itu merupakan pengurangan karena A dan B adalah reaktan sehingga reaktan akan dikonsumsi dalam reaksi dan selalu berkurang. Sedangkan dalam C bertanda positif karena C merupakan produk yang akan selalu bertambah dalam suatu reaksi sehingga memiliki tanda positif.
Hukum Laju dan Konstanta Laju Reaksi
Suatu data eksperimental digunakan dalam penentuan laju suatu reaksi dimana hukum laju dan konstanta laju reaksi ini diperoleh dari penerapan hukum aksi massa. Hukum laju ini mengatur perhitungan sederhana untuk reaksi dengan orde 0, orde 1 dan orde 2:
- Laju pada reaksi orde 0 adalah konstan dan tidak tergantung pada konsentrasi reaktan Laju reaksi = k
- Laju reaksi orde 1 sebanding dengan konsentrasi suatu reaktan Laju reaksi = k [A]
- Laju reaksi orde 2 sebanding dengan kuadrat konsentrasi reaktan baik itu reaktan tunggal maupun dua reaktan Laju reaksi = k [A]2 atau k [A] [B]
Sebagai contoh terdapat reaksi :
aA + bB → cC + dD
Maka hukum laju reaksi yang dapat dituliskan adalah :
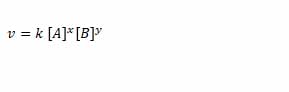
Dimana v adalah laju reaksi, k adalah konstanta laju reaksi, [A] adalah konsentrasi zat A, [B] adalah konsentrasi zat B, x adalah orde reaksi zat A dan y adalah orde reaksi zat B.
Faktor Pengaruh Laju Reaksi
Faktor yang dapat menjadi pengaruh dalam laju reaksi ini, antara lain;
-
Konsentrasi Reaktan
Semakin tinggi konsentrasi suatu reaktan maka jumlah partikel yang terlibat akan semakin banyak. Ketika jumlah partikel yang terdapat dalam suatu tempat semakin banyak, maka peluang terjadinya tumbukan antar partikel juga akan semakin besar karena jumlahnya yang banyak.
Seperti teori tumbukan yang telah dibahas bahwa besarnya peluang terjadinya tumbukan akan membuat laju reaksi juga meningkat. Saat banyak partikel yang bertumbukan maka secara otomatis laju reaksinya juga akan lebih cepat dibandingkan sedikit partikel yang bertumbukan. Oleh karena itu semakin tinggi konsentrasi maka laju reaksi akan semakin besar.
-
Luas Permukaan
Dalam reaksi dengan fase zat padat dan cairan, luas area zat yang bereaksi akan menentukan kecepatan suatu reaksi terjadi. Ketika jumlah permukaan yang mengalami tumbukan dengan partikel reaktan lain semakin banyak, maka hal itu akan menyebabkan efek tumbukan lebih efektif dan akibatnya adalah laju reaksi menjadi semakin tinggi.
Oleh karena itu untuk mempercepat reaksi dalam fase padat, pada umumnya orang akan menghaluskan atau memperkecil ukuran partikel reaktan sehingga semakin banyak permukaan yang mengalami kontak dengan reaktan lain.
-
Tekanan
Dalam reaksi yang melibatkan fase gas didalamnya, peningkatan tekanan akan menyebabkan peningkatan laju reaksi. Ketika tekanan tinggi, maka molekul gas akan cenderung menempati tempat yang lebih sempit sehingga partikel gas akan berdekatan dan memperbesar kemungkinan terjadinya kontak atau tumbukan antar partikel reaktan.
Ketika terjadi tumbukan yang lebih banyak, maka laju reaksi yang terjadi juga akan lebih cepat. Oleh karena itu pada reaksi fase gas, kebanyakan dilakukan pada tekanan tinggi untuk dihasilkan reaksi dengan kecepatan yang tinggi pula.
-
Suhu
Telah banyak eksperimen yang membuktikan bahwa peningkatan suhu akan meningkatkan laju suatu reaksi. Ketika suhu dalam suatu reaksi dibuat tinggi atau ditingkatkan, maka energi minimum yang diperlukan oleh suatu reaktan untuk terjadinya reaksi atau dikenal dengan energi aktivas akan lebih mudah dicapai dalam suhu tinggi karena ada bantuan suhu tersebut.
Selain itu, dalam fase cairan atau larutan suhu tinggi menyebabkan pergerakan partikel yang cepat dan memperbesar kemungkinan terjadinya tumbukan antar partikel. Hal itu juga akan meningkatkan laju reaksi.
-
Katalis
Katalis adalah suatu zat eksternal yang ditambahkan untuk mempercepat suatu reaksi. Katalis ini bekerja dengan cara menurunkan energi aktivasi yang diperlukan untuk terjadinya suatu reaksi. Ketika energi aktivasi yang diperlukan rendah, maka secara otomatis reaksi juga akan lebih cepat.
Oleh karena itu adanya katalis dapat mempercepat suatu reaksi kimia, katalis juga banyak diterapkan dalam industri besar karena dibutuhkan reaksi yang cepat.
-
Sifat Alami dari Reaktan
Setiap zat kimia memiliki sifat alamiah yang berbeda, salah satu sifat yang menentukan kecepatan ketika zat itu bereaksi adalah reaktivitasnya. Suatu zat yang memiliki reaktivitas tinggi pada umumnya akan memiliki laju reaksi yang juga cepat ketika zat tersebut direaksikan dan sebaliknya zat dengan reaktivitas rendah akan memiliki laju reaksi yang rendah.
Oleh karena itu laju reaksi juga ditentukan oleh sifat alami dari suatu zat itu sendiri selain dari faktor eksternal seperti yang telah disebutkan sebelumnya.
Contoh Laju Reaksi
Beberapa contoh terkait dengan laju reaksi dalam kehidupan sehari-hari. Antara lain;
- Memasak, Prihal ini misalnya saja ketika kita memasak makanan maka kita perlu mengetahui tingkat kematangan masakan sehingga kita dapat menghentikan proses memasak dan mencegah terjadinya kegosongan.
- Membuat Minuman, ketika anda membuat es teh manis, anda akan lebih mudah dan cepat melarutkan gula dalam kondisi suhu tinggi daripada anda mencampurkan gula ketika suhu rendah atau telah ditambah es. Pengetahuan seperti itu memang sederhana namun ada dasarnya dalam ilmu kimia dimana kelarutan gula dalam air itu sebanding dengan suhu airnya sehingga gula akan lebih mudah larut dalam suhu tinggi daripada suhu rendah.
Dari penjelasan yang dikemukakan, dapatlah dikatakan bahwa laju yang dikenal dalam kimia sebagai kecepatan reaksi menjadi bagian daripada perubahan konsentrasi pereaksi ataupun produk dalam suatu satuan waktu. Wawaasan sekaligus pemahaman ini sangat penting untuk mempelajari kinetika kimia.
Alasannya karena pengetahuan tentang laju reaksi ini juga sangat berguna dalam kehidupan sehari-hari dan tak hanya pada penggunaan alat laboratorium kimia saja.
Demikianlah rangkaian materi yang dapat dituliskan terkait dengan pengertian laju reaksi menurut para ahli, teori, rumus, hukum dan konstanta, faktor yang mempengaruhi, dan contohnya dalam kehidupan sehari-hari. Semoga melalui tulisan ini bisa memberikan wawasan serta menambah pengetahuan bagi segenap pembaca sekalian.