Ikatan logam bisa dikatakan sebagai salah satu jenis ikatan kimia dimana ikatan ini senantisa menghubungkan dua unsur atom berbeda menjadi suatu molekul. Namun yang pasti, setidaknya terdapat beberapa macam ikatan kimia seperti ikatan kovalen, ikatan ionik, dan ikatan logam.
Ikatan logam ini sendiri memiliki karakteristik yang berbeda dari jenis ikatan kimia yang lain baik dari cara suatu atom berikatan membentuk molekul ataupun dari kekuatan ikatan itu sendiri.
Ikatan Logam
Logam merupakan salah satu unsur yang paling melimpah di bumi dan logam juga mendapatkan perhatian secara khusus dalam penerapan ilmu kimia. Logam dibahas secara detail mengenai jenis atomnya, konfigurasi elektronnya, sifatnya, ikatannya, dan lain lain.
Hal itu karena dalam kimia, logam sendiri memiliki peranan yang cukup besar. Alasannya karena logam banyak dimanfaatkan sebagai pembuatan senyawa katalis, pembuatan kompleks, dan lain sebagainya. Oleh karena itu penting untuk mempelajari tentang bagaimana ikatan logam itu bisa terjadi.
Pengertian Ikatan Logam
Ikatan logam adalah jenis ikatan kimia yang terbentuk antara atom bermuatan positif dengan elektron bebas dari atom atom tersebut, sehingga jikalau dibandingkan dengan ikatan kovalen ataupun ikatan ionik yang terbentuk dari dua atom secara diskrit, ikatan logam terbentuk hanya dari atom atom logam saja.
Ikatan logam juga dapat terjadi pada logam murni atau hanya satu jenis logam ataupun logam paduan yang terdiri dari beberapa jenis atom logam. Ikatan antara atom logam tersebut membentuk suatu zat yang bersifat padat.
Pengertian Ikatan Logam Menurut Para Ahli
Adapun definisi ikatan logam menurut para ahli, antara lain;
- David W Oxtoby (1998), Ikatan logam adalah susunan sistematis dalam kisi kristal yang terdiri dari ion-ion positif logam di dalam lautan elektron dengan sifat mengkilat, dapat menghantarkan arus energi listrik dan kalor dengan baik, mudah ditempa, ulet, dan dapat diulur menjadi kawat.
Proses Terjadinya Ikatan Logam
Tingkat energi dari orbital terluar atom logam (orbital s dan p) dapat mengalami tumpang tindih pada tiap logam. Pada kondisi tersebut, setidaknya ada satu elektron valensi yang akan berpartisipasi dalam ikatan logam. Namun elektron tersebut tidak akan digunakan bersama dengan atom tetangga, juga tidak akan hilang untuk membentuk ion.
Melainkan, elektron akan membentuk sesuatu yang disebut dengan lautan elektron dimana pada kondisi tersebut elektron valensi bebas bergerak dari satu bagian atom ke atom lainnya dalam satu kristal. Interaksi yang terjadi dalam ikatan logam yaitu ikatan atau tarikan antara atom logam yang bermuatan positif dengan elektron yang tersebar pada seluruh bagian kisi logam yang dimodelkan sebagai lautan elektron.
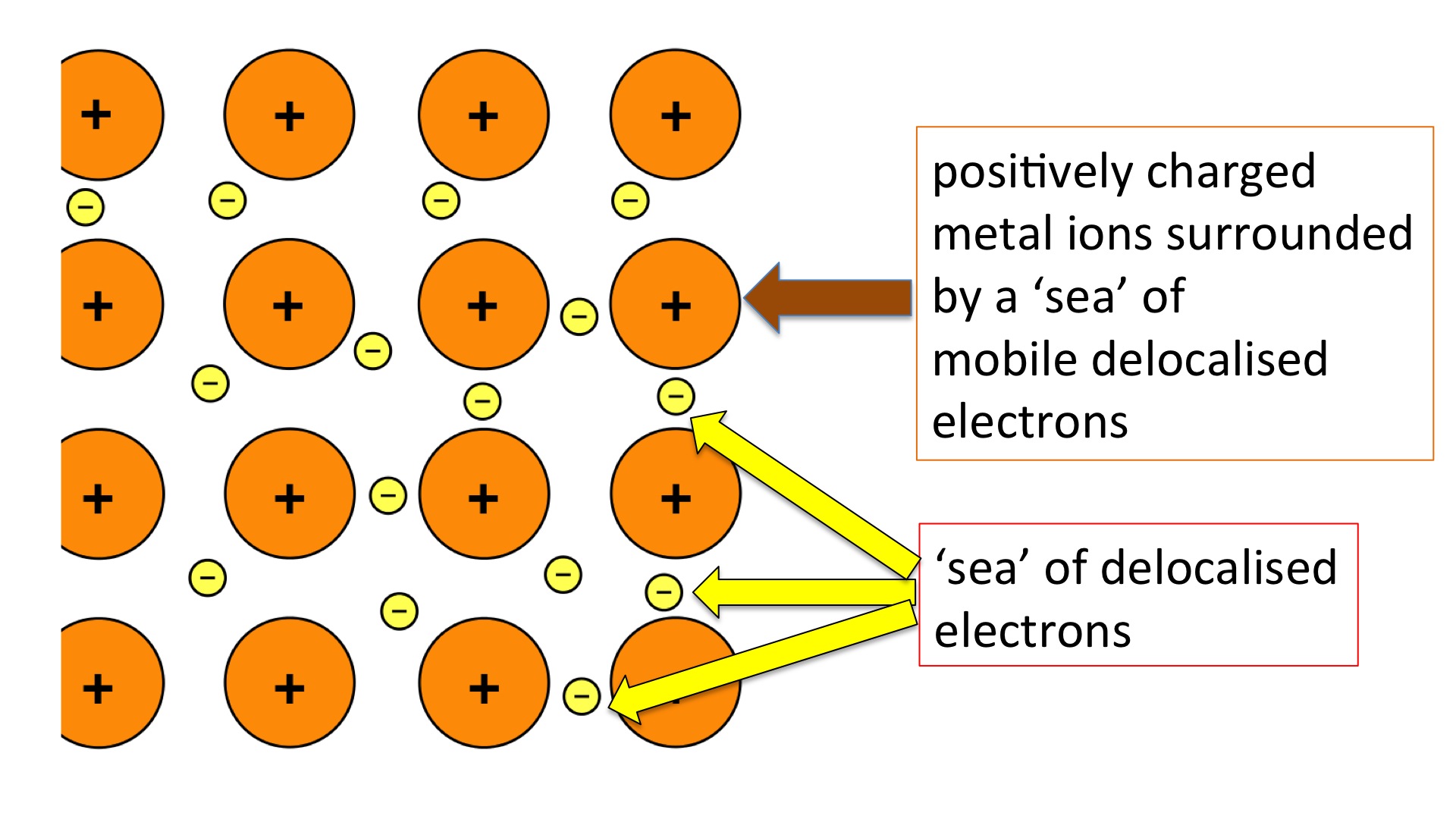
Model lautan elektron adalah sebuah penyederhanaan dalam ikatan logam yang lebih mudah dipahami. Model ini diusulkan oleh Lorentz untuk menjelaskan ikatan logam dan dikenal sebagai model gas elektron atau model laut elektron.
Prinsipnya yaitu didasarkan pada sifat karakteristis logam berikut:
-
Energi ionisasi rendah
Logam umumnya memiliki energi ionisasi yang rendah, artinya bahwa elektron valensi dalam atom logam tidak secara kuat ditarik oleh inti atomnya. Elektron valensi dapat bererak secara bebas dari pengaruh orbital atom serta struktur elektronnya.
-
Orbital kosong
Telah diamati bahwa dalam logam, sejumlah orbital valensi tetap kosong atau tidak berisi elektron karena jumlah elektron valensi yang cenderung lebih sedikit dari jumlah orbital yang ada. Dengan adanya orbital kosong ini memungkinkan terjadinya perpindahan elektron antar orbital secara bebas.
Sebagai contoh pada lithium (Li) memiliki orbital 2p yang kosong, natrium (Na) memiliki orbital 3p dan 5d yang kosong, dan magnesium (Mg) memiliki orbital 3p dan 3d yang kosong.
Dengan adanya model lautan elektron, berikut ini beberapa fitur penting dari model ini :
- Muatan positif atom dapat diatur secara teratur dalam kisi logam
- Elektron valensi memiliki kebebasan secara penuh dalam kisi logam untuk bergerak seperti halnya air pada lautan
- Logam dapat dianggap sebagai lautan elektron dimana terdapat susunan 3 dimensi dari sisi bermuatan positif yang dikelilingi oleh elektron valensi yang bergerak bebas
- Gaya tarik antara elektron dengan atom logam positif dikenal sebagai ikatan logam
Sebagai konsekuensi karena kekuatan ikatan tergantung pada atom yang berpartisipasi di dalamnya, sulit untuk menentukan kekuatan ikatan kimia yang dihasilkan. Namun pada dasarnya kekuatan ikatan logam ini bergantung pada jumlah elektron valensi yang mengalami delokalisasi, muatan dari ion itu sendiri, dan juga jari jari ionik dari kation logam.
Sifat dari ikatan logam itu sendiri yaitu padatan logam tidak dapat larut dalam pelarut apapun. Seperti yang kita ketahui bahwa pelarut anorganik hanya mampu melarutkan padatan ionik, sedangkan pelarut organik mampu melarutkan senyawa kovalen.
Kelarutan didasarkan pada dua faktor utama yaitu polaritas dan jumlah energi yang diperlukan untuk memutuskan gaya antar molekul. Dalam padatan logam, tidak dimungkinkan untuk larut dalam pelarut karena tidak tersedianya ion polar dan membutuhkan banyak energi untuk memutus ikatan logam yang terbentuk.
Sifat Ikatan Logam
Adapun untuk beragam sifat yang ada di dalam ikatan logam ini, antara lain adalah sebagai berikut;
-
Konduktivitas Listrik
Seperti yang telah disinggung di awal bahwa logam merupakan konduktor listrik yang sangat baik. Hal itu dapat kita lihat di sekitar kita dimana saat ini kabel yang digunakan untuk mengalirkan listrik menggunakan logam tembaga sebagai konduktornya.
Sifat konduktivitas listrik itu bisa terjadi karena keberadaan elektron tak terlokalisasi pada logam yang memungkinkannya bergerak bebas. Konduktivitas dapat terjadi karena ada sesuatu partikel yang bergerak untuk menghantarkan listrik, dalam hal ini partikel yang bergerak tersebut adalah elektron yang mampu membawa muatan berupa listrik.
-
Konduktivitas Termal
Selain sebagai penghantar listrik yang baik, logam juga menjadi penghantar termal yang baik. Sifat ini bisa kita temukan ketika kita memanaskan besi pada salah satu ujung, maka semakin lama panas akan merambat dan menuju ujung yang lain.
Hal ini juga lagi lagi disebabkan karena keberadaan elektron bebasnya yang mampu mentransfer energi dari sumber panas dan menyebarkannya ke seluruh bagian logam. Itulah mengapa ketika kita memanaskan besi pada salah satu ujung, maka semua bagian besi akan menjadi panas.
-
Keuletan
Logam pada hakekatnya memiliki kecenderung bersifat elastis atau dapat ditarik menjadi material yang tipis karena ikatan lokal yang terjadi antar atom dapat dengan mudah dipatahkan dan juga direformasi dalam bentuk bagian-bagian benda yang terbuat dari logam.
-
Kelenturan
Dalam pengolahan logam kita mengenal istilah tempa, cara tersebut digunakan untuk membentuk logam menjadi bentuk yang kita inginkan dengan cara ditumbuk. Hal itu didasarkan pada sifat kelenturan logam dimana ikatan antar atom dapat pecah namun juga dapat kembali lagi untuk mengikat pada kondisi tertentu.
-
Sifat Kilap Logam
Logam memiliki tampilan yang terlihat mengkilap atau terdapat kilau. Namun sifat kilap tersebut dapat hilang atau menjadi buram ketika struktur logam mencapai ketebalan minimum. Lautan elektron yang ada pada ikatan logam dapat memantulkan foton dari permukaan yang halus. Namun demikian, terdapat batasan frekuensi cahaya yang dapat dipantulkan oleh logam.
-
Sifat Fisik
Daya tarik yang kuat antar atom dalam ikatan logam membuat logam bersifat keras, memiliki kepadatan atau densitas yang tinggi, titik lebur tinggi, titik didih tinggi, dan volatilitas atau kemudahan untuk menguap yang rendah.
Namun, terdapat pengecualian seperti pada logam pada makna merkuri yang cenderung memiliki tekanan uap tinggi pada kondisi normal.
Contoh Soal dan Jawabannya

Untuk contoh soal dan pembahasan yang disertakan dengan jawaban-jawaban dalam soal ikatan logam ini, antara lain adalah sebagai berikut;
- Tentukan mana yang merupakan ikatan logam!
a. CuSO4
b. NaI
c. FeCl3
d. Fe
Jawaban : d. Fe
- Diantara pilihan berikut, tentukan mana yang memiliki konduktivitas listrik paling baik!
a. HCl
b. H2O
c. Cu
d. Zn
Jawaban : c. Cu memiliki konduktivitas paling baik dibanding Zn dan pilihan lain
Dari penjelasan yang dikemukakan. Yang perlu diketahui bahwa dalam pembahasan jenis ikatan kimia lain, kulit elektron atau orbital terluar dari masing masing atom akan mengalami overlapping atau tumpang tindih dengan orbital atau kulit terluar dari atom lain yang berikatan. Sebagai akibatnya, elektron valensi akan terus bergerak dari satu atom ke atom lain yang berikatan dengan orbital yang sama. Namun, dalam ikatan logam tidak terjadi demikian seperti pada ikatan kovalen, elektron valensi dalam logam tidak terlokalisasi melainkan dapat bergerak secara bebas di seluruh bagian zat.
Ketika atom ditinggalkan oleh elektron tersebut maka akan menjadi ion positif, lalu ketika banyak ion positif terbentuk akibat elektron yang bergerak secara terus menerus akan menyebabkan interaksi antara ion ion di dalamnya. Interaksi antara ion ion dan juga elektron valensi yang bergerak memunculkan gaya kohesi atau ikatan yang menyatukan kristal logam tersebut.
Banyak sifat sifat logam yang dihasilkan dari adanya elektron valensi yang tidak terlokalisasi dan dapat bergerak bebas ini. Seperti pada sifat konduktivitas logam yang tinggi seperti yang kita tahu bahwa logam mampu menghantarkan listrik dan panas dengan baik.
Dalam material, elektron memang memiliki peranan yang sangat penting. Salah satu material lagin selain logam yang memiliki sifat konduktivitas yang baik karena adanya pergerakan elektron secara bebas yaitu pada material grafit dan graphene.
Nah, demikianlah materi yang dapat kami tulisan serta bagikan kepada segenap pembaca terkait dengan pengertian ikatan logam menurut para ahli, proses terjadinya, sifat, contoh soal dan jawabannya. Semoga melalui artikel ini dapat memberikan kepahaman kepada segenap pembaca sekalian.