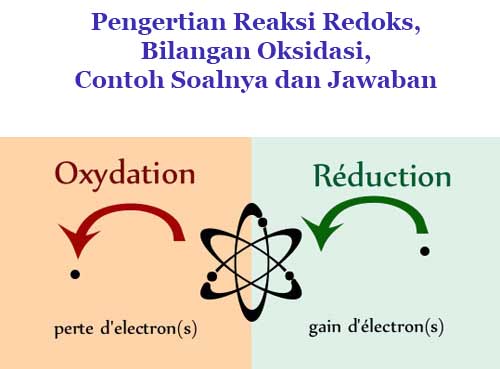
Reaksi redoks bisa dikatakan salah satu reaksi yang terjadi dimana-mana, bahkan di tubuh manusia pun juga mengalami reaksi redoks khususnya dalam proses pernapasan. Reaksi redoks ini sendiri dapat dijelaskan secara penerapan kimia dimana pada reaksi ini terjadi proses oksidasi dan reduksi yang terjadi secara bersamaan.
Selain dalam tubuh manusia, prinsip reaksi redoks banyak diterapkan dalam baterai sehingga mampu menghasilkan energi listrik. Dalam reaksi redoks ini memiliki beberapa perbedaan dengan reaksi kimia biasa. Pada artikel ini akan dibahas pengertian redoks, bilangan oksidasi, cara penyetaraan reaksi serta contohnya.
Reaksi Redoks
Kita sering menemukan bagian logam besi mengalami korosi di sekitar kita, itu merupakan salah satu contoh reaksi redoks yang mudah ditemui pada lingkungan. Korosi pada logam tersebut disebabkan karena adanya sifat oksigen bebas di udara yang mengoksidasi logam tersebut.
Pengertian Reaksi Redoks
Reaksi redoks adalah kependekan dari reaksi reduksi-oksidasi adalah arti reaksi kimia yang dapat menyebabkan perubahan keadaan oksidasi suatu jenis partikel atom. Setiap reaksi redoks selalu melibatkan proses reduksi dan proses oksidasi yang saling berkomplementer dan melibatkan proses transfer elektron antar atom yang bereaksi. Reaksi redoks mencakup semua reaksi kimia dimana atom berubah dari tingkat oksidasinya bisa lebih tinggi atau lebih rendah.
Proses oksidasi merupakan hilangnya elektron atau terjadinya peningkatan keadaan oksidasi suatu atom, molekul ataupun ion. Sedangkan proses reduksi adalah penambahan elektron atau penurunan keadaan oksidasi dari suatu molekul, atom, ataupun ion. Proses reduksi-oksidasi melibatkan transfer elektron, transfer hidrogen ataupun transfer oksigen.
Bilangan Oksidasi
Bilangan oksidasi adalah angka yang menunjukkan keadaan oksidasi suatu atom dan menunjukkan berapa elektron yang dimiliki oleh atom tersebut. Bilangan oksidasi tidak selalu sesuai dengan muatan pada molekul. Dalam suatu reaksi redoks, bilangan oksidasi dapat membantu kita dalam menentukan mana spesies teroksidasi dan mana spesies yang mengalami reduksi.
Ketika satu spesies mengalami peningkatan bilangan oksidasi dari sebelum reaksi hingga setelah reaksi, maka spesies tersebut mengalami oksidasi. Namun, jika bilangan oksidasinya menurun dari sebelum reaksi hingga setelah reaksi maka spesies tersebut dikatakan mengalami reduksi.
Bilangan oksidasi juga berguna dalam penyetaraan persamaan reaksi kimia redoks. Tujuannya yaitu memastikan jumlah total elektron yang hilang dalam oksidasi sama jumlahnya dengan elektron yang diperoleh melalui reduksi. Oleh karena itu sebelum belajar reaksi reduksi oksidasi terlebih dahulu kita harus mengenal bilangan oksidasi.
Cara Menentukan Bilangan Oksidasi
Bilangan oksidasi dapat dituliskan dengan tanda plus (+) atau minus (-) yang kemudian diikuti angka yang menunjukkan besarnya.
- Suatu atom dalam keadaan dasar atau berdiri sendiri memiliki bilangan oksidasi 0, contohnya yaitu atom H2, Fe, Cl2, dan lain-lain.
- Suatu atom yang bermuatan (ion) memiliki bilangan oksidasi sesuai dengan muatannya. Contohnya Fe2+ memiliki bilangan oksidasi +2, ion Cl– memiliki bilangan oksidasi -1.
- Dalam suatu senyawa, logam golongan I A memiliki bilangan oksidasi +1. Contohnya yaitu dalam senyawa NaCl, maka Na memiliki bilangan oksidasi +1+.
- Dalam suatu senyawa, logam golongan II A memiliki bilangan oksidasi +2. Contohnya yaitu CaCO3 dimana Ca memiliki bilangan oksidasi +2.
- Dalam suatu senyawa, logam golongan III A memiliki bilangan oksidasi +3. Contohnya yaitu Al(OH)3 dimana Al memiliki bilangan oksidasi +3.
- Dalam suatu senyawa, unsur halogen memiliki bilangan oksidasi -1. Contohnya yaitu HCl dimana Cl memiliki bilangan oksidasi -1.
- Hidrogen dalam suatu senyawa memiliki bilangan oksidasi +1. Contohnya yaitu dalam HCl, hidrogen memiliki bilangan oksidasi +1.
- O dalam suatu senyawa memiliki bilangan oksidasi -2, namun oksigen dalam peroksida (H2O2) memiliki bilangan oksidasi -1.
- Total jumlah bilangan oksidasi unsur-unsur yang membentuk satu senyawa adalah 0.
- Total jumlah bilangan oksidasi unsur-unsur yang membentuk senyawa ion adalah sesuai muatan ionnya.
Jenis Reaksi Redoks dan Contohnya
Adapun untuk beragam macam reaksi rodoks dalam ilmu kimia, diantaranya adalah sebagai berikut;
-
Reaksi Pembakaran
Reaksi pembakaran adalah salah satu contoh reaksi redoks antara senyawa tertentu dengan oksigen (O2) untuk membentuk produk yang mengandung oksigen. Jika salah satu reaktannya adalah jenis hidrokarbon, maka produk akhirnya adalah air dan karbon dioksida.
Contoh reaksinya yaitu pembakaran oktana yang merupakan suatu hidrokarbon penyusun gasoline dalam mesin kendaraan yang melibatkan reaksi redoks.
2C8H18+25O2→16CO2(g)+18H2O
Dalam hal ini, oktana mengalami oksidasi menjadi karbon dioksida, sedangkan oksigen mengalami reduksi menjadi air.
-
Reaksi Autoredoks
Reaksi autoredoks atau dapat juga disebut dengan disproporsionasi adalah reaksi dimana reaktan tunggal dapat mengalami oksidasi dan reduksi sekaligus sehingga menjadi produk reduksi dan produk oksidasi. Contohnya yaitu reaksi berikut:
3ClO−→ClO3−+2Cl−
Dalam reaksi tersebut kita dapat melihat bilangan oksidasi klorin pada reaktan yaitu +1, namun pada produk menjadi +5 dan -1. Dengan hal tersebut maka klorin mengalami kenaikan bilangan oksidasi (oksidasi) dan mengalami penurunan bilangan oksidasi (reduksi) dalam waktu yang bersamaan.
-
Reaksi Penggantian Tunggal
Reaksi penggantian tunggal adalah reaksi yang melibatkan dua elemen untuk bereaksi seperti logam yang bereaksi dengan asam encer untuk membentuk garam dan gas hidrogen. Berikut ini contoh reaksinya:
Zn+2HCl→ZnCl2+H2
Dalam reaksi tersebut Zn mengalami peningkatan bilangan oksidasi dari 0 menjadi +2, sedangkan Hidrogen mengalami penurunan bilangan oksidasi dari +1 menjadi 0.
Penyetaraan Reaksi Redoks
Untuk menyetarakan reakso redoks dapat dilakukan dengan cara setengah reaksi. Step yang perlu anda lakukan yaitu sebagai berikut:
- Bagi reaksi menjadi setengah reaksi berdasarkan ion
- Setarakan jumlah atom setengah reaksi tersebut secara stoikiometrik melalui penambahan air, ion hidrogen (H+) atau ion hidroksil (OH–) ke dalam setengah reaksi tersebut jika diperlukan.
- Setarakan muatan setengah reaksi dengan menambahkan elektron
- Kalikan masing-masing reaksi dengan konstanta tertentu sehingga memiliki jumlah elektron yang sama
- Tambahkan dua reaksi tersebut dengan elektron yang terlibat antara kedua reaksi harus sama sehingga dapat dihilangkan
Contoh kasusnya yaitu reaksi antara KMnO4 dengan HI dalam larutan asam:
MnO4– + I– → I2 + Mn2+
- Bagi reaksi menjadi dua
I– → I2
MnO4– → Mn2+
- Setarakan jumlah atom dari setenah reaksi, pertama dengan menyetarakan semua atom kecuali H dan O.
2 I– → I2
MnO4– → Mn2+ + 4 H2O
Karena dalam reaksi ini dilakukan pada suasana larutan asam, maka penambahan ion hidrogen dan air diperlukan
MnO4–+8 H+→ Mn2++4 H2O
Dalam setengah reaksi tersebut telah setara untuk jumlah atomnya
- Setarakan muatan dari masing-masing setengah reaksi dengan penambahan elektron.
2 I– → I2 + 2e–
5 e– + 8 H+ + MnO4– → Mn2+ + 4 H2O
- Setarakan jumlah elektron dari kedua reaksi dengan mengalikannya dengan konstanta.
5(2I– → I2 +2e–)
2(5e– + 8H+ + MnO4– → Mn2+ + 4H2O)
Maka dihasilkan setengah reaksi yang setara yaitu :
10 I– → 5 I2 + 10 e–
16 H+ + 2 MnO4– + 10 e– → 2 Mn2+ + 8 H2O
- Tahap terakhir yaitu menambahkan kedua reaksi tersebut menjadi satu reaksi dengan menghilangkan elektronnya.
10 I–+10 e–+16 H++2 MnO4–→ 5I2+2 Mn2++10e–+8H2O
Atau dapat juga dituliskan sebagai:
10 I–+16 H++ 2MnO4–→5 I2+2Mn2++8H2O
Contoh Soal Redoks dan Jawabannya
Agar memperjelas terhadap apa yang sudah dipaparkan tentang materi reaksi rodoks dalam ilmu kimia, berikut inilah contoh soal reaksi rodoks beserta dengan bahasannya. Antara lain;
- Tentukan bilangan oksidasi masing masing atom dalam senyawa H2CO3
H = +1
C = +4
O = -2
- Tentukan bilangan oksidasi masing masing atom dalam Zn(OH)42-
O = -2
H = +1
Zn = +2
- Tentukan mana spesi ter-oksidasi dan ter-reduksi dari reaksi berikut:
2 Cr++Sn4+→Cr3++Sn2+
Cr+ teroksidasi dan Sn4- tereduksi
- Tuliskan reaksi yang setara dari persamaan reaksi berikut :
NaBr+Cl2→NaCl+Br2
2 NaBr+Cl2→2NaCl + Br2
- Setarakan persamaan reaksi berikut jika dilakukan dalam suasana asam :
HCOOH+MnO4–→CO2+Mn2+
6 H+ + 2 MnO4– + 5 HCOOH → 2 Mn2+ + 8 H2O + 5 CO2
Itulah tadi materi yang dapat dituliskan terkait dengan pengertian redoks, bilangan oksidasi, cara penyetaraan, contoh soal dan jawabannya dalam ilmu kimia. Semoga melalui artikel ini bisa memberikan wawasan serta menambah pengetahuan bagi segenap pembaca.


