Elektrokimia diakui ataupun tidak salah satu cabang ilmu kimia yang mempelajari peristiwa yang berhubungan dengan energi listrik dan aliran elektron dalam arti reaksi kimia. Ilmu ini memiliki sangat banyak manfaat dalam kehidupan, sebagai contoh elektrokimia adalah prinsip yang diterapkan dalam semua jenis baterai yang digunakan oleh manusia pada smartphone, laptop, dan lain-lain.
Elektrokimia pada dasarnya akan senantiasa melibatkan reaksi redoks (reduksi oksidasi). Dengan demikianlah, pada artikel ini akan dibahas tentang apa itu elektrokimia, jenis hukum faraday, dan juga contoh soal yang kerapkali muncul dalam daftar pertanyaan.
Elektrokimia
Elektrokimia adalah studi mengenai hubungan antara reaksi kimia dan listrik yang menyertainya. Hal ini termasuk studi tentang arti perubahan kimia yang disebabkan karena keberadaan arus listrik ataupun produksi energi listrik oleh reaksi kimia tertentu.
Pengertian Elektrokimia
Definisi elektrokimia adalah serangkaian pemisahan muatan yang terjadi di dalam media cair sperti larutan. Pemisahan larutan homogen dengan elektrokimia menerapkan prinsip dari reaksi oksidasi dan reaksi reduksi dimana salah satu zat yang dipisahkan nantinya akan mengalami pengendapan menjadi bentuk padatan sehingga dapat dipisahkan dari larutannya. Dalam elektrokimia juga melibatkan dua buah elektroda penghantar yaitu anoda dan katoda.
Pertukaran antara energi listrik dan reaksi kimia memiliki aplikasi yang sangat luas dalam kehidupan manusia seperti penerapan pada prinsip kerja baterai yang memberi daya pada smartphone anda saat ini. Prinsip yang digunakan pada baterai juga menerapkan reaksi redoks dimana oksidasi menyebabkan hilangnya satu atau lebih elektron pada satu spesies kimia sedangkan reduksi adalah penambahan satu atau lebih elektron dalam satu spesies kimia.
Ketika reaksi oksidasi dan reduksi dipasangkan bersama dalam suatu reaksi redoks, elektron dapat mengalir dari spesies ter-oksidasi ke spesies ter-reduksi. Aliran elektron tersebut dapat secara spontan dihasilkan oleh reaksi dan menyebabkan energi listrik dalam satu sel. Hal itulah yang dimanfaatkan pada prinsip kerja baterai yang ada hingga saat ini.
Jenis Sel Elektrokimia
Terdapat dua jenis sel elektrokimia yaitu sel volta dan sel elektrolisis. Berikut ini merupakan penjelasan kedua jenis sel elektrokimia secara lengkap;
-
Sel Volta
Sel volta atau dikenal sebagai sel galvanik merupakan sel elektrokimia yang pertama kali ditemukan pada tahun 1800-an oleh Alessandro Volta dan Luigi Galvani. Hingga saat ini, sel volta ini telah berkembang menjadi komponen baterai seperti yang sudah dibahas sebelumnya.
Dalam pengertiannya, sel volta adalah sel elektrokimia yang didalamnya terjadi reaksi kimia yang menghasilkan energi listrik proporsional.
Sel volta memiliki prinsip kerja yaitu ketika dua plat logam yang berbeda sebagai elektroda secara bersamaan direndam dalam larutan elektrolit yang memiliki reaktivitas lebih tinggi dengan plat tersebut, maka hal ini akan menyebabkan ion logam didalamnya larut sebagai ion bermuatan positif dan meninggalkan elektron bebas pada plat, oleh karena itu plat logam menjadi bermuatan negatif.
Pada plat logam yang lain dimana reaktivitasnya lebih rendah akan cenderung menarik ion positif yang ada pada larutan elektrolit untuk menempel pada permukaannya sehingga menyebabkan plat ini menjadi bermuatan positif. Jika kedua plat ini terhubung melalui sebuah konduktor, maka elektron akan mengalir dan menyebabkan arus listrik terbentuk mengalir melaluinya.
Besar arus listrik yang dihasilkan akan sebanding dengan jumlah muatan positif dan negatif yang ada pada masing-masing plat logam.
Berikut ini merupakan contoh penerapan sel volta;
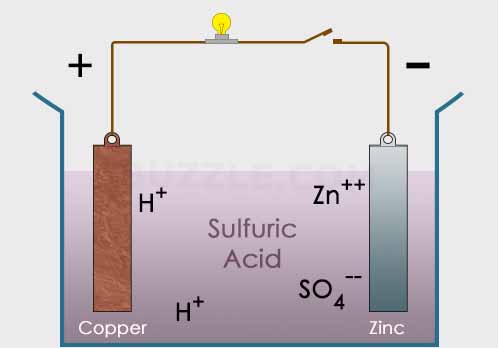
Gambar tersebut menunjukkan sel volta sederhana dimana asam sulfat H2SO4 menjadi larutan elektrolit dalam reaksi tersebut. Sedangkan dua logam sebagai elektroda yaitu zinc (Zn) dan juga tembaga (Cu). Kedua elektroda tersebut dihubungkan dengan sebuah konduktor yang terdapat lampu untuk membuktikan keberadaan arus listrik.
Pada larutan : H2SO4 –> 2H+ + SO42-
Pada larutan : Zn2+ + SO42- –> ZnSO4
Pada elektroda Zn : Zn –> Zn2+ + 2 e–
Pada elektroda Cu : 2H+ + 2e– –> H2 (gas)
Logam Zn memiliki potensial reduksi sebesar -0.62 V sedangkan logam Cu memiliki potensial reduksi sebesar 0.46 sehingga total potensial listrik yang dihasilkan oleh sel tersebut adalah 0.46-(-0.62) = 1.08 V. Dengan logam Zn mengalami oksidasi sedangkan Cu mengalami reduksi.
-
Sel Elektrolisis
Sel elektrolisis adalah jenis lain dari sel elektrokimia dimana sel elektrolisis ini bekerja dengan prinsip yang berlawanan dengan sel volta. Sel elektrolisis merupakan sel elektrokimia yang mendorong terjadinya reaksi kimia dengan adanya aliran listrik di dalamnya.
Sel elektrolisis bekerja dengan digunakan juga dua elektroda yang direndam dalam larutan elektrolit dimana kedua elektroda yang digunakan memiliki perbedaan potensial dengan adanya sumber listrik sehingga menyebabkan salah satu elektroda bermuatan positif sedangkan satu yang lainnya bermuatan negatif.
Adanya listrik menyebabkan usur elektrolit cair dipecah menjadi ion positif dan ion negatif dimana ion negatif akan tertarik ke dalam elektroda positif sedangkan ion positif akan diendapkan menjadi padatan yang menempel pada elektroda yang bermuatan negatif. Dengan prinsip demikian, sel elektrolisis dapat digunakan dalam pemisahan suatu zat dari senyawa tertentu.
Berikut ini contoh dari sel elektrolisis;
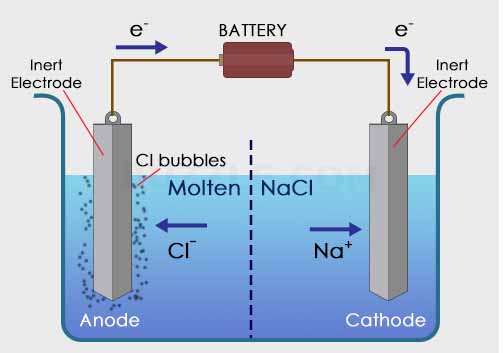
Digunakan larutan NaCl sebalai larutan elektrolit dan dua buah elektroda sebagai anoda dan katoda serta dialiri oleh listrik melalui sebuah baterai. Ketika arus listrik dialirkan, maka elektroda akan bermuatan positif dan negatif. Elektroda positif akan menarik ion Cl– dalam larutan, sedangkan elektroda negatif akan menarik ion Na+ dalam larutan NaCl.
Pada katoda : Na+ + e– –> Na (endapan)
Pada anoda : 2Cl– –> + Cl2 + e–
Total reaksi : 2 NaCl –> 2Na (padat) + Cl2 (gas)
Perbedaan Sel Volta dan Sel Elektrolisis
Adapun untuk memperjelas, berikut ini adalah perbedaan yang ada dalam sel volta dan elektrolisisnya. Antara lain;
- Sel Volta
Yaitu;
- Reaksi kimia menghasilkan energi listrik
- Digunakan 2 elektroda logam berbeda
- Anoda bermuatan negatif, katoda bermuatan positif
- Reaksi spontan
- Sel Elektrolisis
Yakni;
- Energi listrik menghasilkan reaksi kimia
- Digunakan 2 elektroda inert yang sama
- Anoda bermuatan positif, katoda bermuatan negatif
- Reaksi tidak spontan
Hukum Faraday dalam Elektrokimia
Hubungan antara jumlah muatan listrik yang melewati suatu larutan elektrolit dan jumlah zat yang terdapat dalam elektroda dinyatakan oleh Faraday pada tahun 1834 dalam suatu hokum elektrolisis. Hukum Faraday pertama menyatakan bahwa massa suatu zat yang diendapkan atau dibebaskan di setiap elektroda berbanding lurus dengan jumlah muatan yang terlibat.
Dalam hukum kedua Faraday menyatakan bahwa massa suatu zat yang diendapkan atau dibebaskan pada elektroda berbanding lurus dengan muatan yang melaluinya. Secara persamaan matematis, hukum Faraday dapat diperoleh persamaan berikut:
w = (e I t) / F
Dimana w adalah massa zat yang diendapkan dalam gram, e adalah massa ekuivalen (Mr/valensi), I adalah kuat arus dalam ampere, t adalah waktu dalam second, sedangkan F adalah tetapan Faraday (96.500 coloumb).
Contoh Soal Elektrokimia
Sebagai penjelasan lebih lanjut, berikut inilah rangkaian penjelasan terkait dengan contoh soal serta pembahasan jawaban atas materi elektrokimia. Diantaranya;
Itulah tadi materi yang dapat dikemukakan terkait dengan penjelasan tentang pengertian elektrokimia, jenis sel dalam elektrokimia, hukum faraday, contoh soal dan jawabannya. Semoga melalui artikel ini dapat memberikan penjelasan kepada segenap pembaca sekalian.


