Reaksi kimia bisa dikatakan hal mendasar yang dapat terjadi pada setiap senyawa kimia. Senyawa kimia organik adalah senyawa kimia yang berasal dari makhluk hidup ataupun senyawa organik juga dapat didefinisikan sebagai senyawa kimia yang tersusun dari atom karbon, hidrogen, oksigen, fosfor, sulfur, ataupun golongan halogen. Mempelajari reaksi organik merupakan materi fundamental yang harus dipelajari untuk menuju ke tingkat yang lebih advance dalam penerapan kimia organik. Hal itu karena dalam kimia organik, reaksi-reaksi dasar ini akan selalu digunakan dalam membentuk sebuah mekanisme reaksi.
Jika selama ini kita mengetahui adanya reaksi pembakaran, reaksi pembentukan, reaksi penetralan, dan lain lain, maka reaksi organik ini sifatnya lebih dasar dan lingkupnya lebih luas. Misalnya dalam reaksi pembakaran dapat melibatkan salah satu atau lebih jenis reaksi organik ini ataupun dalam reaksi pembentukan juga demikian. Oleh karena itu penting untuk mempelajari reaksi organik ini sebelum belajar kimia organik lebih jauh.
Reaksi Organik
Pengertian reaksi kimia organik merupakan reaksi yang terjadi dalam senyawa organik yang melibatkan terjadinya perpindahan suatu atom dan menghasilkan jenis struktur senyawa organik yang baru. Reaksi organik ini terjadi secara mendasar dalam skala atom sehingga pasti akan mempengaruhi keseluruhan senyawa tersebut.
Dalam perubahan kimia telah kita ketahui bahwa perubahan sedikit dalam skala struktural akan menghasilkan sifat senyawa yang berbeda. Reaksi organik ini dapat terjadi karena berbagai hal yang mempengaruhi dan menginisiasi terjadinya reaksi seperti pengaruh eksternal seperti suhu, keasaman, adanya katalis, adanya radikal dan lain lain.
Pengertian Reaksi Organik Menurut Para Ahli
Definisi reaksi organik menurut para ahli, antara lain;
- Carey dan Sundberg, Definisi reaksi organik adalah perubahan senyawa organik melalui reaksi kimia yang mengubah ikatan-ikatan antara atom-atom karbon dan unsur lainnya.
- Clayden, Greeves, dan Warren, Pengertian reaksi organik adalah perubahan senyawa organik melalui reaksi kimia yang melibatkan pembentukan atau pemutusan ikatan kovalen antara atom-atom karbon dan unsur lainnya.
- Morrison dan Boyd, Definisi reaksi organik adalah reaksi kimia yang melibatkan senyawa-senyawa organik dan berlangsung dengan pembentukan ikatan kimia baru atau pemutusan ikatan kimia yang sudah ada.
- IUPAC (International Union of Pure and Applied Chemistry), Arti reaksi organik adalah reaksi kimia yang melibatkan senyawa-senyawa organik dan mengubah ikatan-ikatan kimia yang ada di dalamnya.
Jenis Reaksi Organik
Pada umumnya senyawa organik berada dalam bentuk hidrokarbon dimana kita tahu bahwa hidrokarbon merupakan senyawa yang terdiri dari atom karbon yang membentuk rantai dan mengikat hidrogen dengan jumlah tertentu.
Dalam reaksinya, hidrokarbon dapat mengalami pelepasan atom hidrogen ataupun pelepasan dalam atom karbonnya. Bagaimana proses terjadinya pelepasan atom tersebut akan mengikuti jenis jenis reaksi organik ini. Berikut ini adalah jenis jenis reaksi organik yang harus dipelajari.
-
Reaksi Substitusi
Dalam reaksi substitusi, umumnya suatu kelompok atom atau suatu senyawa dapat terbentuk dari atom lain atau sekelompok atom lain yang mengarah pada pembentukan senyawa baru secara bersamaan. Secara mudah, reaksi substitusi dapat digambarkan dengan lepasnya satu atom dalam suatu senyawa dan digantikan secara langsung oleh atom atau senyawa lain yang berperan sebagai reaktan untuk mengisi ruang kosong yang ditinggalkan atom sebelumnya.
Hal itu akan menghasilkan struktur senyawa yang baru karena atom atau senyawa penggantinya berbeda dari atom awalnya.
Terjadinya reaksi substitusi dapat disebabkan karena berbagai faktor salah satunya yaitu pengaruh perbedaan elektronegativitas yang akan membuat tarikan elektron ke salah satu atom dan membuat ikatan yang terjadi menjadi lemah dan mudah untuk diputuskan. Kita dapat mengambil contoh dari ikatan C-Cl dimana karbon bermuatan parsial positif karena mengikat klorin yang bersifat elektronegatif sehingga menarik elektron dari karbon.
Dalam reaksi substitusi nukleofilik (nukleofilik adalah senyawa atau atom yang bermuatan negatif), sangat penting bagi nukleofil untuk memiliki pasangan elektron bebas yang memiliki afinitas besar terhadap spesi elektropositif (dalam hal ini yaitu karbon) sehingga akan lebih mudah dalam mengikat atom karbon elektropositif tersebut.
Dalam terjadinya reaksi substitusi, terdapat berbagai parameter kondisi yang harus diatur seperti suhu dan tekanan yang akan mempengaruhi reaksi. Selain itu, keasaman juga akan berpengaruh sehingga penambahan basa kuat seperti NaOH akan berperan penting dalam reaksi ini.
Contoh Reaksi Substitusi
H3C-Cl + NaOH → H3C-OH + NaCl
Dapat kita lihat bahwa senyawa awal merupakan CH3Cl yang direaksikan dengan NaOH dimana OH berperan sebagai nukleofil.
Terjadinya reaksi substitusi diawali dengan pemutusan ikatan C-Cl sehingga ion Cl– akan terlepas, setelah itu akan diikuti dengan pembentukan ikatan baru antara C yang ditinggalkan oleh Cl dengan OH sehingga terbentuk C-OH baru. Oleh karena itu dihasilkan senyawa akhir berupa CH3OH. Reaksi substitusi ini adalah konversi senyawa haloalkana menjadi alkohol.
-
Reaksi Eliminasi
Jika reaksi substitusi melibatkan pemecahan ikatan dan pembentukan ikatan baru dalam satu senyawa, maka dalam reaksi eliminasi melibatkan terjadinya pemindahan atom atom dalam satu senyawa dan menghasilkan ikatan rangkap secara simultan dengan pelepasan molekul dari satu senyawa menghasilkan dua atau lebih senyawa.
Secara mudah, reaksi eliminasi adalah pelepasan molekul kecil dari satu senyawa yang kemudian senyawa yang melepaskan tersebut akan membentuk ikatan rangkap baru di dalamnya.
Adanya ikatan rangkap yang baru merupakan sebuah perubahan yang secara kimia akan mempengaruhi keseluruhan senyawa tersebut baik dari segi struktural maupun sifatnya.
Pada umumnya, terjadinya reaksi eliminasi ini melalui inisiasi eksternal seperti adanya panas, adanya radikal atau adanya katalis dari senyawa lain yang ditambahkan. Namun dalam hal ini senyawa lain yang ditambahkan tidak akan bereaksi dengan senyawa awal, melainkan hanya berperan sebagai katalis saja.
Contoh Reaksi Eliminasi
CH3CH2Cl → CH2=CH2 + HCl
Contoh reaksi eliminasi yang khas yaitu konversi senyawa etil klorida menjadi etilena. Dalam reaksi tersebut senyawa etil klorida (CH3CH2Cl) dengan inisiasi tertentu akan mengeliminasi atau melepaskan molekul HCl yang secara detail terbentuk dari pelepasan H+ dan Cl– yang kemudian akan bertemu dan membentuk HCl.
Ruang kosong dalam pelepasan dua atom tersebut pada senyawa etil klorida akan saling berinteraksi menghasilkan ikatan rangkap baru dan terbentuklah senyawa baru etilena yang memiliki satu ikatan rangkap.
-
Reaksi Adisi
Jika dalam reaksi eliminasi terjadi pelepasan molekul kecil menghasilkan suatu ikatan rangkap, dalam reaksi adisi adalah kebalikan dari reaksi eliminasi. Reaksi adisi merupakan reaksi penambahan suatu molekul ke dalam senyawa lain yang akan mengakibatkan pembukaan ikatan rangkap menjadi ikatan tunggal.
Pada umumnya, dalam reaksi adisi ini dua reaktan akan menghasilkan satu produk akhir reaksi yang memiliki sifat dan struktur berbeda dari awalnya. Terjadinya reaksi adisi juga disebabkan karena faktor inisiasi tertentu sama seperti pada reaksi eliminasi.
Namun, pada umumnya reaksi adisi lebih mudah terjadi karena ikatan rangkap mengandung ikatan phi yang cenderung lemah dan mudah untuk dibuka. Ketika ikatan phi tersebut terbuka maka dengan mudah molekul lain untuk berikatan dengan ikatan yang telah terbuka tersebut.
Contoh Reaksi Adisi
HCl + CH2=CH2 → CH3CH2Cl
Karena kita berbicara bahwa reaksi adisi merupakan kebalikan dari reaksi eliminasi, maka kita ambil contoh reaksi kebalikan dari eliminasi. Jika sebelumnya, etil klorida bereaksi menghasilkan HCl dan etilena, maka dalam reaksi adisi HCl akan bereaksi dengan etilena untuk menghasilkan etil klorida.
Reaksi ini terjadi dengan inisiasi tertentu yang akan mengakibatkan salah satu ikatan rangkap tepatnya pada ikatan phi akan terbuka sehingga terjadi kekosongan elektron. Hal itu akan membuat HCl dengan mudah masuk dalam ikatan tersebut dengan H+ ke dalam sisi yang kelebihan elektron dan Cl– akan masuk dalam sisi yang kekurangan elektron. Proses ini terjadi akan menstabilkan senyawa menghasilkan tingkat energi yang lebih rendah.
-
Reaksi Penataan Ulang
Jenis reaksi organik dasar terakhir yaitu reaksi penataan ulang. Dalam reaksi ini, terjadi reorganisasi dalam skala struktural dengan kata lain bahwa suatu senyawa kimia organik dengan struktur tertentu akan mengalami perubahan struktur dengan adanya penataan ulang yang terjadi dalam satu molekul itu sendiri. Pada umumnya, reaksi penataan ulang akan menghasilkan isomer dari senyawa itu sendiri.
Reaksi penataan ulang ini umumnya tidak melibatkan zat lain yang bereaksi terhadapnya. Zat lain mungkin saja berperan sebagai katalis namun tidak akan bereaksi dengan senyawa awal. Selain adanya katalis, hal yang mungkin menyebabkan terjadinya penataan ulang adalah kondisi asam basa dalam suatu senyawa serta adanya pemanasan.
Contoh Reaksi Penataan Ulang
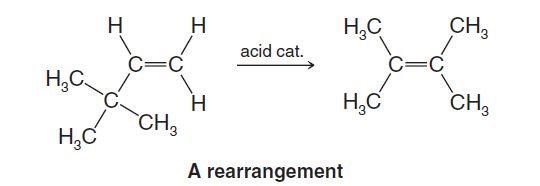 Reaksi penataan ulang tersebut terjadi pada senyawa alkena yaitu 3,3-dimetil-1-butena dimana dengan adanya katalis asam dalam hal ini asam kuat akan menginisiasi senyawa tersebut untuk mengalami reaksi penataan ulang menghasilkan isomernya yaitu senyawa 2,3-dimetil-2-butena.
Reaksi penataan ulang tersebut terjadi pada senyawa alkena yaitu 3,3-dimetil-1-butena dimana dengan adanya katalis asam dalam hal ini asam kuat akan menginisiasi senyawa tersebut untuk mengalami reaksi penataan ulang menghasilkan isomernya yaitu senyawa 2,3-dimetil-2-butena.
Terjadinya penataan ulang ini diawali dengan perpindahan ikatan rangkap yang berada pada atom karbon nomor 1 menjadi atom karbon nomor 2. Hal ini akan mempengaruhi senyawa secara keseluruhan baik struktur maupun sifatnya.
Nah, itulah tadi penjelasan secara lengkap kepada segenap pembaca terkait dengan beragam jenis-jenis reaksi organik dan contohnya dalam ilmu kimia. Semoga melalui materi ini bisa memberikan wawasan dan menambah pengetahuan bagi pembaca sekalian.



Reaksi organik apa yang sering terjadi dalam bidang ilmu kehutanan