Konsep mol bisa dikataan sebagai ilmu dasar yang harus dikuasai dalam mempelajari penerapan kimia yang lebih dalam. Kita tidak dapat menghindarinya karena ilmu kimia modern telah mengeksplorasi aspek secara kualitatif dan kuantitatif. Semua yang ada dalam kimia juga berhubungan dengan perhitungan seperti halnya perhitungan massa relatif suatu unsur yang membentuk senyawa dalam suatu reaksi kimia.
Dalam arti reaksi kimia, konsep mol sangat berperan penting untuk menentukan bagaimana suatu produk bisa terjadi dan bagaimana hasil kuantitatifnya. Dalam artikel ini akan dibahas tentang pengertian konsep mol, perhitungan dan contoh soalnya.
Konsep Mol
Jauh sebelum konsep mol dikembangkan, diakui ataupun tidak sejatinya ada serangkaian ide tentang kesetaraan kimia dalam jumlah tertentu dari zat yang dapat bereaksi dengan zat lain pada tingkat yang sama.
Gagasan ekivalen kimia dinyatakan oleh Henry Cavendish pada tahun 1767, diklarifikasi oleh Jeremias Richter pada 1795 dan dipopulerkan oleh William Wollaston pada tahun 1814. Wollaston menerapkan konsep tersebut ke dalam atom-atom dan mendefinisikannya sehingga satu ekuivalen dari suatu elemen sesuai dengan massa atomnya.
Pengertian Konsep Mol
Dalam kimia, mol adalah unit dasar yang digunakan dalam sistem satuan internasional (SI) sehingga secara internasional perhitungan untuk mengukur jumlah zat menggunakan satuan mol. Kuantitas ini juga terkadang disebut sebagai jumlah bahan kimia.
Mol berupa sebuah angka yang nilainya sama dengan bilangan Avogadro yaitu 6.022*1023 yang menyatakan jumlah partikel. Jadi, ketika seseorang menyatakan suatu materi jumlah molnya adalah 1, maka materi tersebut mengandung sebanyak 6.022*1023 jumlah partikel. Dalam hal ini jumlah partikel dapat berarti atom, molekul, ion, elektron, atau elemen lainnya.
Identitas suatu zat tidak hanya didefinisikan oleh jenis atom atau ion yang dikandungnya, namun juga oleh jumlah dari masing-masing jenis atom atau ion.
Sebagai contoh, air (H2O) dan hidrogen peroksida (H2O2) keduanya sama-sama mengandung atom hidrogen dan oksigen, yang membedakan yaitu pada jumlah atom yang dimilikinya dimana pada air hanya mengandung satu oksigen sedang pada ikatan hidrogen peroksida mengandung dua buah atom oksigen.
Konsep mol memberikan ukuran spesifik jumlah atom atau molekul dalam suatu sampel materi yang besar. Satu mol didefinisikan sebagai jumlah zat yang mengandung entitas diskrit yang sama. Mol menyediakan hubungan antara sifat makroskopik yang mudah diukur, massa, dan sifat dasar lain yang sangat penting seperti jumlah atom, jumlah molekul, dan jumlah partikel.
Perhitungan Massa Molar
Sesuai dengan definisinya sebagai satuan jumlah, 1 mol elemen apapun akan mengandung jumlah atom yang sama dengan 1 mol elemen lainnya. Akan tetapi, massa 1 mol elemen dapat berbeda dengan massa 1 mol elemen lain karena massa atom secara individu juga berbeda.
Dengan hal ini maka muncul istilah Massa Molar yang biasa ditampilkan sebagai Massa Atom untuk zat dengan atom tunggal atau pada gabungan atom (senyawa) hal ini disebut sebagai massa relatif. Massa molar ini dinyatakan dalam satuan gram per moll yang dapat didefinisikan sebagai massa untuk satu mol zat tersebut. Massa molar ini akan sangat berguna dalam perhitungan yang melibatkan massa zat dan mol.
Sebagai contoh yaitu pada atom karbon yang memiliki nomor atom 6 dan nomor massa 12. Kita dapat mengetahui bahwa atom karbon memiliki massa 12 gram setara dengan 1 mol atom karbon tersebut. Ketika kita menemukan atom karbon dengan massa 24 gram, itu berarti atom karbon berada dalam jumlah 2 mol.
Sama halnya dengan oksigen yang memiliki nomor massa 16, itu berarti untuk 1 mol oksigen membutuhkan 16 gram oksigen. Ketika atom karbon bereaksi dengan oksigen dan membentuk karbon dioksida (CO2), maka kita dapat menghitung massa relatif dari CO2 yaitu :
Pada CO2 mengandung 1 atom C dan 2 atom O
1 x massa C = 1 x 12 = 12 gram/mol
2 x massa o = 2 x 16 = 32 gram/mol
Total = 12 + 32 = 44 gram/mol
Jadi untuk molekul CO2 memiliki massa relatif sebesar 44 gram/mol.
Rumus Perhitungan Konsep Mol
Konsep mol dapat diterapkan untuk berbagai situasi, pada umumnya konsep mol ini selalu digunakan dalam membuat reaksi kimia. Hal itu berguna untuk menentukan berapa massa zat yang akan direaksikan sehingga jumlahnya setara dan efisien untuk bereaksi.
Dalam suatu reaksi, jumlah mol sangat menentukan reaksi terutama dalam menentukan produk yang akan terbentuk. Sebagai contoh untuk membentuk produk H2O dalam suatu reaksi, dibutuhkan sebanyak 2 mol hidrogen dan 1 mol oksigen.
Ketika jumlah tersebut tidak terpenuhi maka H2O juga tidak akan terbentuk, itulah mengapa konsep mol ini sangat menentukan reaksi kimia.
Untuk menghitung mol, kita dapat mengkonversinya dari jumlah zat awal yang diketahui baik dengan satuan konsentrasi (untuk larutan), volume (untuk gas), massa (untuk padatan), atau jumlah partikel. Konsep mol untuk perhitungan tersebut dapat dilihat dalam gambar berikut;
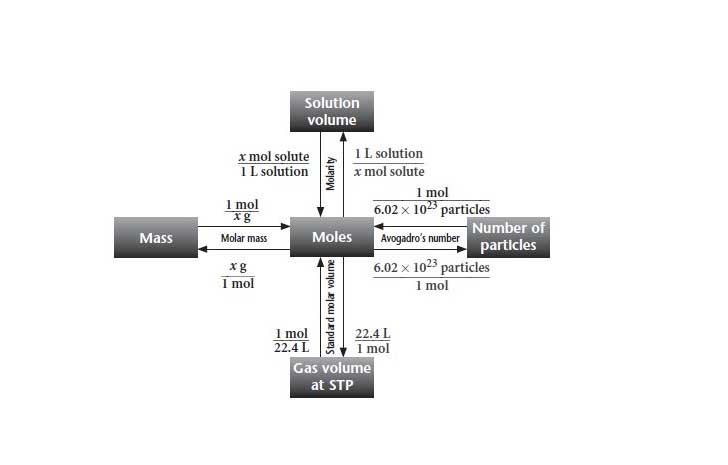
Jika diketahui massa zat
Untuk menghitung jumlah mol jika diketahui massa awal suatu zat ini seperti yang telah dicontohkan pada bagian awal.
Dalam hal ini anda perlu mengetahui rumus kimia dari zat tersebut, rumus kimia ini dapat berupa jenis atom atau rumus senyawanya. Rumus kimia tersebut akan digunakan dalam menentukan massa molar zat tersebut berdasarkan massa jenis partikel atomnya.
Jika diketahui massa molekul H2O sebesar 50 gram, tentukan jumlah molnya!
Step 1 : Menghitung massa molar H2O
2 x massa H = 2 x 1 = 2 gram/mol
1 x massa O = 1 x 16 = 16 gram/mol
Massa molar H2O = 2 + 16 = 18 gram/mol
Step 2 : Menghitung mol H2O
Mol = Massa Zat / massa molar
Mol H2O = 50 / 18 = 2.7 mol
-
Jika diketahui volume zat
Volume zat ini pada umumnya diterapkan dalam perhitungan mol untuk zat dengan fasa gas. Dalam keadaan STP atau Standar Temperature & Pressure, 1 mol setara dengan 22.4 L zat gas apapun jenisnya. Untuk menggunakan perhitungan ini anda harus memastikan terlebih dahulu bahwa zat gas diukur dalam keadaan STP, karena pada keadaan diluar STP 1 mol belum tentu setara dengan 22.4 L gas.
Tentukan jumlah mol gas H2 yang diukur pada keadaan STP sebanyak 1.5 L!
Step : Menghitung mol gas H2
Mol = Volume / 22.4
Mol H2 = 1.5 / 22.4 = 0.0669 mol
-
Jika diketahui konsentrasi
Konsentrasi merupakan satuan ukuran untuk suatu larutan. Jika dalam larutan tersebut diketahui jenis zat dan konsentrasinya serta jumlah volume total larutan, maka anda dapat menghitung jumlah mol zat tersebut. Satuan konsentrasi dapat didefinisikan sebagai jumlah mol zat terlarut dalam 1 liter pelarut yang pada umumnya pelarutnya yaitu air. Satuan yang paling umum untuk konsentrasi adalah Molaritas (M) yang sama dengan mol/L.
Diketahui HCl 0.5 M sebanyak 25 mL, tentukan jumlah molnya!
Step 1 : Mengubah satuan volume menjadi liter
25 mL = 0.025 L
Step 2 : Menghitung mol HCl dalam larutan
Mol = Konsentrasi x Volume
Mol HCl = 0.5 M x 0.025 L = 0.0125 mol
-
Jika diketahui jumlah partikel
Jika suatu materi hanya diketahui jumlah partikelnya, maka dalam hal ini anda dapat menerapkan prinsip yang digagas oleh Avogadro, dimana 1 mol suatu materi setara dengan 6.022*1023 partikel. Partikel yang dimaksud dapat berarti atom, elektron, atau jenis partikel lain.
Diketahui jumlah mol suatu zat adalah 0.05 mol, tentukan jumlah partikelnya!
Step : Menghitung jumlah partikel
Mol = jumlah partikel / 6.022*1023
Maka
Jumlah partikel = Mol x 6.022*1023
Jumlah partikel = 0.05 mol x 6.022*1023 = 3.011*1022 partikel
Nah, demikianlah materi yang menjelaskan tentang pengertian konsep mol, perhitungan dan contoh soal konsep mol beserta jawabannya. Semoga melalui artikel ini dapat memberikan wawasan serta refrensi kepada segenap pembaca yang mencari literasi terkait kimia.


