Ikatan kimia tentu menjadi penghubung antara atom yang berikatan dalam suatu senyawa kimia. Ikatan kimia ini memiliki peranan penting dalam menentukan bagaimana sifat dan karakteristik suatu molekul atau senyawa. Banyak pula faktor yang menentukan bagaimana ikatan kimia bisa terbentuk ataupun terpecah melalui sebuah reaksi kimia.
Dalam arti kimia dasar, ikatan kimia menjadi bahasan yang penting karena ikatan merupakan hal dasar yang dimiliki oleh atom dalam membentuk suatu senyawa. Oleh karena itu kita harus memahami tentang bagaimana suatu atom dapat membentuk ikatan dan bagaimana karakteristik ikatan yang dibentuk tersebut. Dalam artikel ini terdapat contoh-contoh soal pilihan ganda ikatan kimia dalam kehidupan sehari-hari secara lengkap.
Ikatan Kimia
Ikatan kimia adalah interaksi yang terjadi dalam sebuah senyawa antara atom dengan atom lain sehingga saling terhubung dan membentuk sebuah senyawa yang stabil. Dalam pembentukan ikatan kimia, elektron memiliki peranan yang sangat penting karena ikatan kimia akan terjadi pada elektron terluar suatu atom dengan atom yang lain.
Terdapat beberapa macam ikatan kimia yang harus kita ketahui yakni jenis ikatan kovalen, ikatan ionik dan ikatan logam. Dalam ikatan kovalen, ikatan kimia terjadi karena adanya atom atom yang saling berbagi elektron untuk digunakan secara bersama antara atom yang berikatan. Hal ini memungkinkan kedua atom untuk berikatan dengan kuat dengan adanya penggunaan elektron dalam orbital yang sama oleh kedua atom.
Ikatan ionik merupakan ikatan kimia yang terbentuk karena adanya suatu atom yang kekurangan elektron sehingga akan bermuatan positif (kation) dan juga adanya atom yang kelebihan elektron sehingga bermuatan negatif (anion). Kedua jenis atom bermuatan akan saling tarik menarik karena perbedaan muatan dan membentuk sebuah ikatan ionik.
Sedangkan ikatan logam atau metalik merupakan sebuah ikatan kimia yang terjadi oleh sebuah gaya elektrostatik antara awan elektron dengan ion logan dimana ion logam ini memiliki muatan positif.
Pada dasarnya, setiap jenis ikatan tersebut dapat terjadi karena kondisi tertentu dan tentunya disebabkan oleh sifat masing masing atom yang terlibat. Setiap ikatan juga memiliki sifat yang berbeda sehingga kita juga dapat membedakan sebuah ikatan dalam suatu senyawa.
Contoh Soal Ikatan Kimia
Adapun contoh soal ikatan kimia dan pembahasannya secara lengkap. Antara lain sebagai berikut;
1. Diantara pasangan atom berikut ini, manakah yang dapat membentuk senyawa dengan ikatan ionik.
a. Ca dan Ni
b. Cu dan Ar
c. F dan S
d. Zn dan K
e. Na dan Cl
Natrium merupakan suatu atom logam alkali dimana atom tersebut dapat kehilangan satu elektron sehingga bermuatan positif atau menjadi kation Na+. Sedangkan Cl merupakan atom golongan halogen yang cenderung menarik elektron sehingga akan menjadi anion yang bermuatan negatif Cl–. Kedua atom bermuatan tersebut akan saling tarik menarik untuk berikatan membentuk ikatan ionik dalam senyawa NaCl
2. Elektronegativitas merupakan sebuah informasi yang berhubungan dengan…
a. Prediksi polaritas suatu ikatan
b. Menentukan berapa elektron yang terlibat dalam ikatan
c. Membentuk aturan oktet
d. Menentukan jumlah ikatan tunggal dalam suatu molekul
e. Menentukan apakah ikatan ganda terbentuk dalam molekul
Nilai elektronegativitas dari atom dapat kita gunakan untuk memprediksi polaritas suatu ikatan yang terbentuk. Jika antara kedua atom yang berikatan itu memiliki nilai perbedaan elektronegativitas yang signifikan, maka ikatan tersebut berjenis ikatan kovalen polar contohnya ikatan kovalen polar pada HCl dan HF.
Sedangkan jika perbedaan elektronegativitas antara kedua atom rendah atau sama dengan nol, maka jenis ikatannya yaitu kovalen non polar contohnya yaitu pada ikatan O2 atau H2.
3. Dalam gas metana, jenis ikatan apakah yang terjadi dalam senyawa tersebut
a. Ikatan ionik
b. Ikatan kovalen polar
c. Ikatan kovalen non polar
d. Ikatan logam
e. Ikatan kovalen koordinasi
Metana memiliki struktur CH4 dimana dalam senyawa tersebut terdapat ikatan C-H. Kita dapat mengetahui bahwa ikatan C-H merupakan ikatan kovalen karena tidak memungkinkan terjadi ikatan ionik maupun ikatan logam.
Selanjutnya jenis ikatan kovalen apa yang terjadi antara C-H kita dapat menggunakan nilai elektronegativitas kedua atom tersebut. Atom C memiliki nilai elektronegatifitas 2.55 sedangkan atom H memiliki elektronegativitas 2.2. Selisih nilai elektronegativitas kedua atom yakni 0.35 dimana nilai ini sangat kecil sehingga dapat dikatakan bahwa antara atom C dan atom H berikatan secara ikatan kovalen non polar.
4. Pilihlah diantara senyawa berikut yang memiliki kekuatan ikatan paling besar.
a. CO2
b. N2
c. HCl
d. Cl2
e. O2
Dalam pilihan jawaban tersebut kita dapat menuliskan struktur dengan ikatannya sebagai berikut.
O=C=O untuk CO2
NN untuk N2
H-Cl untuk HCl
Cl-Cl untuk Cl2
O=O untuk O2
Kita dapat melihat beberapa jenis ikatan yang berbeda. Ikatan terkuat adalah yang memiliki jumlah ikatan terbanyak dalam hal ini N2 memiliki ikatan rangkap tiga dimana itu merupakan ikatan yang paling banyak diantara yang lain. Hal itu membuat N2 memiliki ikatan lebih kuat diantara pilihan yang lain.
5. Manakah diantara senyawa berikut yang merupakan senyawa polar
a. CCl4
b. N2
c. CH4
d. CO2
e. H2O
Jenis ikatan kovalen dapat ditentukan berdasarkan perbedaan elektronegativitas antara atom yang berikut.
CCl4 memiliki perbedaan elektronegativitas 0.61
N2 tidak memiliki perbedaan elektronegativitas atau merupakan senyawa non polar
CH4 memiliki perbedaan elektronegativitas 0.35
CO2 memiliki perbedaan elektronegativitas 0.89
H2O memiliki perbedaan elektronegativitas 1.24
Berdasarkan nilai tersebut kita dapat mengetahui bahwa H2O memiliki perbedaan elektronegativitas paling besar sehingga H2O paling polar diantara senyawa yang lain.
6. Mengapa senyawa ionik dapat larut dalam air
a. Molekul air memiliki bentuk yang memungkinkan untuk mengelilingi ion dalam larutan
b. Air bereaksi dengan ion
c. Air bersifat polar sehingga dapat menarik ion positif dan negatif
d. Air akan terpecah dan bereaksi dengan masing masing ion
e. Air bersifat reaktif
Jawaban paling tepat adalah karena air bersifat polar sehingga dapat menarik ion positif dan negatif. Dalam air, oksigen memiliki polaritas tinggi sehingga cenderung bermuatan negatif dan mampu menarik ion positif dari senyawa ionik. Sedangkan hidrogen dalam air memiliki elektronegativitas lebih rendah sehingga cenderung bermuatan positif dan akan menarik ion negatif dari senyawa ionik.
7. Berapa elektron yang terlibat antara ikatan karbon dalam senyawa gas etilen
a. 2
b. 3
c. 4
d. 5
e. 6
Senyawa etilen memiliki struktur lewis H-CC-H. Seperti yang kita ketahui bahwa setiap ikatan melibatkan pemakaian dua elektron secara bersama oleh kedua atom. Dalam etilen, karbon berikatan secara rangkap tiga sehingga memiliki 3 ikatan kovalen dimana setiap ikatan memiliki 2 elektron yang digunakan bersama. Maka dari itu dalam ikatan karbon rangkap tiga akan memiliki total 6 elektron yang digunakan bersama oleh kedua atom untuk tiga ikatan.
8. Dalam struktur lewisnya atom boron memiliki 3 titik, hal itu mengindikasikan bahwa
a. Hanya dapat berikatan dengan 3 atom
b. Hanya dapat membentuk ikatan rangkap tiga
c. Memiliki 3 elektron valensi
d. Memiliki elektronegativitas 3
e. Tidak dapat membentuk ikatan rangkap tiga
Jawaban paling tepat untuk pernyataan bahwa boron memiliki 3 titik dalam struktur lewis adalah dimana boron memiliki 3 elektron valensi. Struktur lewis menggambarkan suatu atom dengan elektron valensi yang digambarkan sebagai titik dimana titik tersebut akan digunakan untuk berikatan dengan atom lain.
9. Apakah bentuk geometri molekul dari karbon dioksida
a. Tetrahedral
b. Trigonal piramidal
c. Heksagonal
d. Linear
e. Trigonal planar
Kita dapat mengetahui bentuk molekul karbon dioksida dari melihat struktur lewis dari CO2 yang digambarkan sebagai berikut.
O=C=O
Dengan berjumlah 2 ikatan, maka bentuk yang paling stabil adalah linear dimana dengan bentuk ini, kedua atom O akan saling berjauhan sehingga hal ini akan membuat senyawa tersebut lebih stabil.
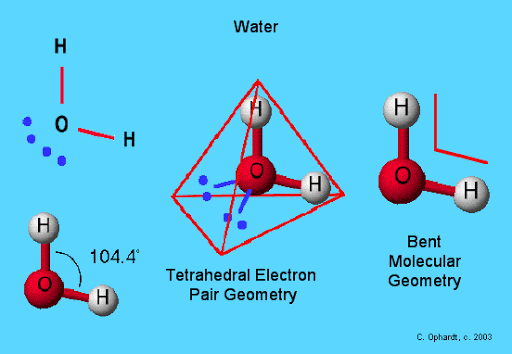
10. Apakah bentuk geometri molekul dari air
a. Linear
b. Bentuk V
c. Tetrahedral
d. Trigonal piramidal
e. Heksagonal
Jika kita berpikir bahwa molekul air dengan rumus H2O memiliki bentuk linear sama seperti CO2 maka itu adalah hal yang salah. Berbeda dengan CO2, air memiliki pusat yaitu atom oksigen dimana oksigen alam air memiliki 2 pasangan elektron bebas yang tidak digunakan untuk berikatan. Adaanya pasangan elektron bebas yang berukuran besar dalam oksigen ini akan memberikan desakan terhadap atom hidrogen lain dalam air sehingga membuat atom hidrogen tidak lagi berposisi linear namun akan membentuk V shape yang stabil. Kita dapat melihatnya dalam struktur berikut.
Dengan 2 pasangan elektron bebas yang digambarkan dengan 2 titik biru akan membentuk struktur tetrahedral. Jika kita hanya melihat atom oksigen dan hidrogennya, maka geometri strukturnya adalah bentuk V.
Itulah tadi uraian lengkap yang bisa kami tuliskan kepada segenap pembaca. Berkaitan dengan contoh soal ikatan kimia, jawaban, dan pembahasannya. Semoga bisa memberikan wawasan serta referensi yang mumpuni bagi pembaca sekalian.