Hibridisasi menjadi salah satu fenomena dalam arti sifat kimia yang di dalamnya terjadi saat pembentukan suatu molekul kimia. Sehingga prihal inilah istilah hibridisasi paling sering terjadi pada molekul hidrokarbon dengan jenis partikel atom karbon dan hidrogen saat membentuk senyawa hidrokarbon.
Disisi lainnya, dengan adanya hibridisasi dalam kimia ini maka struktur dari molekul yang terbentuk memiliki panjang dan sudut ikatan tertentu yang seragam sehingga kemudian pada akhirnya mampu membentuk geometri yang dapat ditentukan.
Hibridisasi
Dalam penerapan kimia teori hibridisasi pada hakekatnya menjadi salah satu teori dasar yang harus dikuasai. Hal itu karena teori hibridisasi akan berguna dalam penentuan bentuk geometri suatu molekul dan juga penentuan jenis ikatan dari adanya suatu atom. Selain itu, hibridisasi juga berpengaruh dalam tingkat energi dari suatu senyawa serta tingkat kestabilannya.
Oleh karena itulah bahasan tentang hibridisasi dan teorinya sangat lekat dalam proses terjadinya hibridisasi orbital dan juga contoh senyawa yang dihasilkan dari hibridisasi.
Pengertian Hibridisasi
Hibridisasi adalah penggambaran atas serangkaian proses penggabungan orbital dari suatu atom dengan atom lain ketika terjadinya pemaknaan ikatan kimia sehingga pada akhirnya mencapai energi yang lebih rendah atau kestabilan yang tinggi.
Prihal ini terjadinya dua atom akan berikatan secara kimia, maka dua atom ini membutuhkan sebuah orbital kosong untuk ditempati elektron dari masing masing atom tersebut sehingga setelah berikatan maka kedua jenis partikel atom akan menempati orbital yang sama pada elektron valensinya.
Oleh karena itu dalam proses hibridisasi ini melibatkan konfigurasi elektron terutama pada elektron valensi yang digunakan untuk berikatan. Untuk mempelajari tentang elektron dan konfigurasi elektron dapat anda baca lebih lengkap pada pengertian konfigurasi elektron.
Pengertian Hibridisasi Menurut Para Ahli
Adapun definisi hibridisasi menurut para ahli, antara lain;
- Mario Raimondi (1994), Hibridisasi adalah konsep pengenalan terkait dengan bersatunya orbital-orbital atom dalam upaya membentuk orbital hibrid yang baru dengan terjadi kesesuai terkait dengan kualitatif sifat ikatan atom.
Teori Hibridisasi
Kajian hibridisasi terjadi ketika suatu molekul tidak mengalami hibridisasi orbital pada pembentukan ikatannya, maka yang teradi yaitu panjang dan sudut ikatan yang terbentuk akan berbeda beda dan tingkat energinya pun berbeda.
Akibatnya akan menghasilkan bentuk yang tak beraturan, namun pada kenyataannya molekul kimia memiliki panjang dan sudut ikatan yang seragam serta bentuk yang beraturan dan dapat ditentukan. Prihal ini, sebagai contoh pada molekul metana (CH4) dimana atom karbon memiliki elektron valensi sebanyak 4 yang digunakan dapat untuk berikatan dengan atom lain dan terdapat pada orbital 2s dan 2p.
Ketika karbon membentuk ikatan misalnya dengan hidrogen, secara teoritis orbital 2s dan 2p yang memiliki tingkat energi berbeda maka akan menghasilkan ikatan dengan panjang, sudut dan tingkat energi yang berbeda pula karena jenis orbital yang berbeda.
Namun pada kenyataannya, senyawa CH4 memiliki panjang ikatan untuk setiap ikatan C-H yang sama, selain itu sudut ikatan yang terbentuk dan energinya pun sama menghasilkan bentuk geometri tetrahedral. Sehingga dipastikan bahwa terjadi sesuatu yang membuat orbital itu menghasilkan tingkat energi yang setara, karena tidak mungkin karbon dan hidrogen berikatan dengan orbital 2s dan 2p yang berbeda menghasilkan panjang, sudut, dan energi ikatan yang sama.
Peristiwa itu yang dinamakan hibridisasi orbital dimana orbital 2s bergabung dengan orbital 2p yang terdiri dari 3 orbital p sehingga membentuk orbital sp3 yang mampu menghasilkan bentuk geometri molekul CH4 sebagai tetrahedral.
Macam Hibridisasi
Pada atom karbon, dapat terjadi bebera jenis hibridisasi orbital yang menghasilkan panjang ikatan, sudut ikatan, kekuatan ikatan serta energi ikatan yang berbeda untuk tiap hibridisasi. Materi tentang hidrokarbon juga dapat anda pelajari secara lebih lengkap pada artikel pengertian hirdokarbon.
Berikut ini merupakan jenis jenis hibridisasi orbital pada atom karbon. Yaitu;
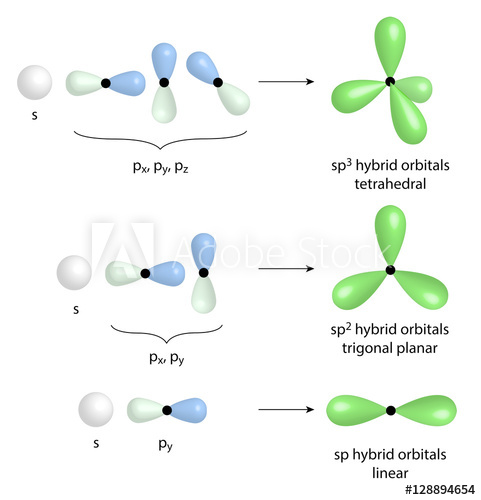
-
Hibridisasi sp3
Hibridisasi sp3 merupakan hibridisasi yang melibatkan penggabungan 1 orbital s dengan 3 orbital p yang terdiri dari px, py, dan pz menghasilkan sp3 yang dapat digunakan untuk berikatan dengan 4 atom lain.
Hibridisasi sp3 memiliki jenis ikatan tunggal atau satu ikatan sigma dimana kekuatan ikatan pada hibridisasi ini paling lemah diantara hibridisasi lainnya, sedangkan panjang ikatan pada hibridisasi ini yang paling besar diantara lainnya. Molekul dengan hibridisasi sp3 akan menghasilkan bentuk geometri tetrahedral. Contoh hibridisasi sp3 adalah pada molekul CH4.
-
Hibridisasi sp2
Pada hibridisasi sp2, sesuai namanya merupakan penggabungan 1 orbital s dengan 2 orbital p sehingga terdapat 1 orbital p bebas yang tidak digunakan untuk hibridisasi. Hibridisasi sp2 menghasilkan jenis ikatan rangkap 2 sehingga kekutan ikatannya lebih tinggi daripada ikatan tunggal dan panjang ikatan yang dihasilkan juga lebih pendek.
Dalam hibridisasi ini ikatan rangkap dapat terjadi karena adanya 1 orbital p bebas yang dapat membentuk ikatan phi dengan orbital dari atom lain. Hibridisasi sp2 akan menghasilkan bentuk geometri planar dengan sudut ikatan 120. Contohnya saja molekul yang memiliki hibridisasi sp2 adalah C2H4.
-
Hibridisasi sp
Hibridisasi sp merupakan penggabungan antara 1 orbital s dengan 1 orbital p sehingga terdapat 2 orbital p bebas yang tidak digunakan. Hibridisasi sp menghasilkan jenis ikatan rangkap 3 karena terdapat 2 orbital p bebas yang masing masing dapat menghasilkan ikatan phi dengan orbital atom lain sehingga secara keseluruhan hibridisasi ini memiliki 1 ikatan sigma dan 2 ikatan phi.
Akibatnya, kekuatan ikatan menjadi kuat lebih kuat daripada dua hibridisasi lainnya dan jarak ikatan juga paling pendek. Bentuk molekul yang dihasilkan hibridisasi sp adalah linear dengan sudut 180. Contoh molekul dengan hibridisasi sp adalah C2H2.
Proses Terjadinya Hibridisasi
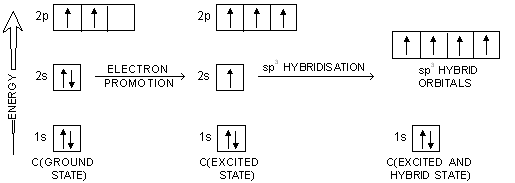
Dalam terjadinya hibridisasi melibatkan beberapa proses. Secara keseluruhan proses hibridisasi dapat dilihat pada skema gambar berikut yang menampilkan proses atau tahapan hibridisasi yang disertai dengan tingkat energi untuk setiap tahap dan setiap orbital.
-
Keadaan Dasar (Ground State)
Dalam keadaan dasar, semua unsur atom pada dasarnya memiliki konfigurasi elektron seperti pada umumnya. Akan tetapi, pada kondisi ini tingkat energi dari masing masing orbital berbeda dan relatif lebih tinggi sehingga kurang stabil.
-
Eksitasi atau Promosi Elektron
Pada tahap eksitasi atau yang juga disebut dengan promosi, salah satu elektron dari orbital 2s akan tereksitasi menuju ke orbital kosong pada 2p karena pada orbital 2p masih terdapat 1 orbital kosong. Dengan hal tersebut, maka semua orbital yaitu 2s dan 2p terpenuhi oleh elektron dengan masing masing terisi 1 elektron.
-
Hibridisasi
Tahap terakhir yaitu hibridisasi atau penggabungan antar orbital dimana pada sp3 maka orbital 2s akan bergabung dengan tiga orbital 2p membentuk sp3 dan seterusnya.
Sehingga pada akhirnya, dengan adanya penggabungan tersebut maka didapatkan level energi yang lebih rendah dan setara untuk keempat jenis orbital. Hal itulah yang menyebabkan panjang ikatan, sudut ikatan, dan energi ikatannya sama.
Contoh Molekul dengan Hibridisasi Orbital
Adapun untuk memperjelaskanya berikut ini merupakan beragam contoh melekul dengan hibridisasi orbital, antara lain adalah sebagai berikut;
-
Metana (CH4)
Seperti yang telah dijelaskan diawal bahwa pada senyawa metana memiliki hibridisasi sp3 yang menyebabkan tiap ikatan C-H memiliki panjang, sudut, dan energi ikatan yang setara. Molekul CH4 umumnya memiliki sudut ikatan 109.5 dengan bentuk geometri tetrahedral. Hal itu merupakan hasil dari hibridisasi orbital yang terjadi pada atom karbon tersebut.
-
Etilena (C2H4)
Etilena yang juga merupakan senyawa hidrokarbon memiliki hibridisasi orbital sp2 dimana antara atom C pada senyawa tersebut dihubungkan melalui ikatan rangkap 2 yang terdiri dari satu ikatan sigma dan satu ikatan phi.
Selain mengikat karbon yang lain, karbon pada senyawa etilena juga mengikat dua atom hidrogen dengan sudut ikatan yang sama yaitu 120. Akibatnya didapatkan bentuk geometri berupa planar atau datar pada senyawa etilena ini.
-
Asetilena (C2H2)
Berbeda dengan kedua senyawa di atas, asetilena merupakan senyawa hirdokarbon dengan ikatan rangkap 3 yang terdiri dari 1 ikatan sigma dan 2 ikatan phi. Hal ini akibat dari hibridisasi orbital yang merupakan hibridisasi sp sehingga menghasilkan 2 orbital p bebas.
Bentuk geometri dari senyawa ini adalah linear atau berupa garis lurus karena selain mengikat karbon yang lain, karbon pada asetilena mengikat satu atom hidrogen lain.
Dari penjelasan yang dikemukakan, dapatlah dikatakan bahwa teori dasar hibridisasi sebaiknya dikuasai terlebih dahulu sebelum belajar tentang bentuk geometri dari suatu molekul. Hal itu karena dalam penentuan bentuk geometri suatu molekul, maka kita harus dapat menentukan hibridisasi yang terjadi pada orbital atom yang berikatan dalam molekul tersebut.
Demikian artikel tentang pengertian hibridisasi menurut para ahli, teori, macam, proses terjadinya, dan contoh senyawa yang melibatkan hibridisasi orbital. Semoga saja tulisan yang disajikan ini mampu memberi wawasan bagi kalian.



