Senyawa hidrokarbon aromatik merupakan salah satu dari tiga kelas senyawa yang terkandung dalam minyak bumi. Jumlahnya lebih sedikit daripada hidrokarbon alkana dan sikloalkana, namun senyawa hidrokarbon aromatik ini sangat bernilai secara komersial. Sebagian besar dari senyawa aromatik hidrokarbon berupa senyawa dalam arti benzena.
Hidrokarbon Aromatik
Hidrokarbon adalah senyawa kimia organik dimana sturktur senyawa ini tersusun dari atom karbon yang membentuk suatu rantai dan juga atom hidrogen. Pembentukan rantai karbon dapat terjadi dalam beberapa bentuk seperti struktur linear, bercabang, ataupun berbentuk siklik.
Adanya bentuk siklik ini memungkinkan senyawa hidrokarbon untuk menjadi sebuah senyawa hidrokarbon aromatik. Seperti yang kita ketahui bahwa terdapat tiga jenis hidrokarbon yakni hidrokarbon aromatik, hidrokarbon alifatik, dan hidrokarbon siklik.
Senyawa aromatik dapat ditemukan dalam berbagai macam sumber seperti dalam minyak bumi ataupun dalam tar batu bara. Senyawa hidrokarbon poliaromatik menjadi komponen dari polusi atmosfer yang diketahui memiliki sifat karsinogenik bagi manusia. Poliaromatik merupakan senyawa yang memiliki dua atau lebih gugus aromatik dalam satu senyawa. Senyawa aromatik ini juga sangat menarik karena perannya dalam kehidupan sebagai prekursor pembentukan asam amino dalam tubuh.
Pengertian Hidrokarbon Aromatik
Pengertian hidrokarbon aromatik adalah senyawa organik yang tak jenuh dimana senyawa ini memiliki struktur siklik dan mengandung ikatan sigma yang memungkinkan terjadinya delokalisasi elektron phi. Senyawa aromatik juga disebut dengan senyawa arena ataupun aril.
Secara sederhana, hidrokarbon aromatik merupakan senyawa hidrokarbon siklik yang memiliki ikatan rangkap secara berselang seling. Namun, masing masing ikatan rangkap tersebut memiliki elektron yang dapat berpindah dari satu atom ke atom lain sehingga posisi ikatan rangkap tersebut tidak dapat dipastikan secara tepat karena terus berpindah sesuai dengan pergerakan elektron.
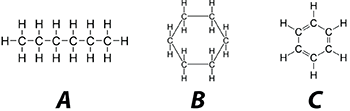
Jika kita lihat pada gambar tersebut itu merupakan tiga jenis hidrokarbon dimana gambar A merupakan hidrokarbon alifatik, B merupakan hidrokarbon siklik dan C merupakan hidrokarbon aromatik. Berdasarkan strukturnya ketiga senyawa tersebut memiliki jumlah atom karbon yang sama yakni 6 atom karbon. Namun jika kita lihat strukturnya memiliki perbedaan yang sangat signifikan.
Dari ketiga senyawa tersebut, hidrokarbon aromatis memiliki stabilitas struktur yang paling tinggi. Hal itu karena adanya resonansi elektron phi yang membuatnya sangat stabil. Berbeda dengan senyawa alifatik yang hanya tersusun dari rantai karbon yang tidak memiliki awan elektron phi.
Kita mengenal senyawa hidrokarbon aromatik pada benzena yang merupakan senyawa aromatik paling banyak. Namun sebenarnya tidak hanya atom karbon yang mampu membentuk senyawa aromatik melainkan atom lain seperti nitrogen, oksigen dan sulfur juga bisa karena atom atom tersebut mampu membentuk ikatan rangkap dua yang memungkinkan terjadinya pergerakan elektron.
Namun terdapat senyawa lain yang memiliki struktur mirip dengan benzena yakni senyawa sikloheksatriena. Senyawa ini memiliki gambar struktur yang sama persis dengan senyawa benzena dimana terdiri dari rantai hidrokarbon siklik dengan 6 atom karbon yang saling terikat dan juga terdapat 3 ikatan rangkap yang berselang seling.
Kedua senyawa ini memiliki struktur yang sama persis namun secara sifat, benzena merupakan senyawa aromatik sedangkan sikloheksatriena merupakan senyawa alifatik. Pembuktian perbedaan kedua senyawa ini dilakukan dengan reaksi hidrogenasi.
Reaksi hidrogenasi untuk satu ikatan rangkap dalam senyawa sikloheksena membutuhkan energi 28.6 kcal sehingga untuk tiga ikatan rangkap akan membutuhkan energi 85.8 kcal. Namun, untuk menghidrogenasi tiga ikatan rangkap pada benzena hanya membutuhkan 36 kcal. Hal itu membuktikan bahwa benzena berbeda dengan senyawa sikloheksatriena.
Cincin benzena memiliki stabilitas yang disebabkan karena sifat aromatisnya. Reaktivitas dari senyawa aromatik sangat ditentukan oleh elektron pada sistem phi dari cincin benzena itu sendiri. Beberapa jenis reaksi yang terjadi hampir sama dengan senyawa alkena. Hal itu karena keberadaan ikatan rangkap dua dari atom karbon-karbon pada senyawa aromatik hidrokarbon.
Benzena memiliki kemampuan untuk bereaksi dengan senyawa lain sehingga terjadi penggantian gugus hidrogen dengan gugus fungsi lain. Penggantian gugus fungsi tersebut dapat terjadi dalam satu atau lebih atom hidrogen. Ketika lebih dari satu gugus fungsi yang bereaksi maka struktur benzena yang baru dapat memungkinkan terjadi beberapa posisi gugus fungsi tersebut yang mempengaruhi sifat dari senyawa tersebut.
Sifat Senyawa Aromatik
Benzena merupakan senyawa pertama yang dikategorikan sebagai senyawa hidrokarbon aromatik. Setiap karbon dalam senyawa benzena memiliki ikatan rangkap antar karbon dengan ikatan sigma dan ikatan phi dimana elektron dalam ikatan phi ini yang terdelokalisasi serta satu ikatan sigma dengan hidrogen.
Elektron phi yang terdelokalisasi pada benzena diilustrasikan dengan gambar lingkaran dalam struktur heksagonal benzena. Hal itu menandakan bahwa ikatan rangkap tidak diam mengikuti elektronnya. Berikut ini adalah beberapa sifat dari senyawa aromatik hidrokarbon.
- Memiliki stabilitas yang sangat tinggi dengan adanya resonansi elektron dalam struktur senyawa aromatik.
- Rasio atom karbon dengan atom hidrogen dalam senyawa aromatik relatif tinggi.
- Ketika terbakar, senyawa hidrokarbon aromatik memiliki nyala api yang kuat dan berwarna kuning.
- Senyawa hidrokarbon aromatik dapat mengalami reaksi substitusi elektrofilik dan substitusi nukleofilik.
Reaksi Hidrokarbon Aromatik
Banyak tipe reaksi kimia organik yang dapat terjadi dalam senyawa hidrokarbon aromatik. Berikut ini adalah beberapa contoh reaksi pada senyawa aromatik.
-
Reaksi Substitusi Aromatik
Reaksi substitusi aromatik ini merupakan reaksi penggantian dari salah satu substituen dalam cincin aromatik yang mana adalah hidrokarbon. Dalam senyawa hidrokarbon aromatik, setiap karbon mengikat satu atom hidrogen dimana salah satu atau lebih dari atom hidrogen ini dapat mengalami substitusi dengan atom ataupun gugus fungsi yang lain.
Reaksi substitusi yang dapat terjadi dalam senyawa aromatik adalah reaksi substitusi nukleofilik dimana gugus substituen yang datang cenderung memiliki muatan negatif, lalu reaksi substitusi elektrofilik dengan gugus datang bermuatan positif, serta reaksi substitusi nukleofilik radikal dimana gugus datang merupakan suatu senyawa radikal.
Reaksi substitusi nukleofilik dapat terjadi jika suatu senyawa nukleofil menggantikan substituen dari cincin aromatik. Keberadaan gugus penarik elektron yang terikat pada senyawa aromatik dapat mempercepat reaksi substitusi nukleofilik.
Sedangkan reaksi substitusi elektrofilik terjadi pada suatu senyawa elektrofil sebagai reagen. Reaksi ini termasuk reaksi nitrasi aromatik, halogenasi aromatik, sulfonasi aromatik, serta Friedel-Craft asilasi dan alkilasi. Reaksi ini dapat melibatkan resonansi karbokation yang stabil dalam pembentukan intermediet reaksi.
-
Reaksi Coupling
Dalam reaksi ini, dapat terjadi penggabungan antara dua fragmen yang memiliki radikal dengan bantuan suatu katalis logam. Ketika suatu senyawa hidrokarbon aromatik mengalami reaksi coupling, maka akan dapat terbentuk beberapa jenis ikatan.
Pertama yaitu ikatan karbon-karbon dimana hal ini terjadi pada reaksi antara senyawa arena dengan produk seperti vinil arena, alkil arena dan lain lain. Lalu dapat terbentuk ikatan karbon-oksigen dimana ikatan ini terjadi pada reaksi yang membentuk senyawa ariloksi, dan terakhir yaitu ikatan karbon-nitrogen yang membentuk produk seperti senyawa anilin.
-
Reaksi Hidrogenasi
Reaksi lain yang dapat terjadi pada senyawa hidrokarbon aromatik adalah reaksi hidrogenasi. Sesuai namanya, reaksi ini merupakan proses penambahan hidrogen dalam suatu senyawa. Reaksi hidrogenasi ini akan membentuk suatu cincin yang bersifat jenuh.
Dengan artian yaitu akan terjadi pembukaan ikatan rangkap sehingga akan menjadi ikatan tunggal dan dikatakan sebagai senyawa jenuh karena memiliki kandungan hidrogen yang tinggi.
Contoh dan Kegunaan Senyawa Hidrokarbon Aromatik
Senyawa hidrokarbon aromatik yang paling umum adalah senyawa benzena. Contoh lain dari senyawa hidrokarbon aromatik adalah senyawa turunan benzena seperti toluena, fenol, anilin, benzaldehida, dan lain lain. Manfaat dan kegunaan senyawa aromatik ini juga sangat beragam.
- Sebagai pigmen warna hijau dalam tumbuhan berdaun diketahui sebagai klorofil dan memiliki peran yang sangat penting dalam produksi makanan tumbuhan.
- Digunakan sebagai pelarut seperti toluena atau metil benzena.
- Senyawa hidrokarbon aromatik naftalena digunakan dalam pembuatan kapur barus.
- Senyawa phenanthrene digunakan dalam sintesis obat, pewarna, dan bahan peledak.
- Senyawa trinitrotoluena merupakan senyawa hidrokarbon aromatik yang banyak digunakan dalam peledak.
- Industri plastik dan petrokimia menggunakan senyawa hidrokarbon aromatik dalam produksinya.
Demikian ulasan lengkap yang bisa kami utarakan pada segenap pembaca, berkenaan dengan pembahasan tentang pengertian hidrokarbon aromatik, sifat, reaksi, dan contohnya. Semoga postingan ini dapat membantu dan bermanfaat bagi semuanya.