Afinitas elektron secara sederhana bisa dikatakan sebagai bagian daripada kemampuan dari suatu jenis partikel atom dalam menerima elektron. Prihal ini terjadi ketika elektron ditambahkan dalam atom pada wujud gas, maka secara langsung terjadi perubahan energi tertentu.
Oleh karena itulah afinitas elektron dalam suatu atom cenderung sulit untuk diukur. Alasannya karena adanya nilai afinitas elektron hanya tersedia pada beberapa jenis unsur kimia tertentu, terutama pada golongan halogen.
Afinitas Elektron
Afinitas elektron bisa dikatakan sebagai peristiwa yang terjadi karena adanya komponen melepas dan menerima elektron terhadap sesuatu yang umum dalam penerapan kimia. Dimana untuk serah terima elektron dapat terjadi ketika suatu atom melakukan interaksi dengan atom lain dalam membentuk ikatan kimia. Oleh karena itu adanya afinitas elektron ini berpengaruh dalam interaksi antar atom.
Pengertian Afinitas Elektron
Afinitas elektron adalah jumlah energi yang dilepaskan ketika suatu elektron diterima oleh atom netral dan membentuk ion yang bermuatan negatif, dimana untuk nilai dari afinitas elektron didapatkan dari pengukuran panas pembentukan dan energi kisi dari unsur senyawa ionik.
Pengertian Afinitas Elektron Menurut Para Ahli
Adapun definisi afinitas elektron menurut para ahli. Antara lain;
- Dr. Yusnidar Yusuf, M. Si (2018), Afinitas elektron ialah ukuran besarnya energi yang dibebaskan oleh atom dalam menerina sebuah elektron. Sehingga besaran afinitas elektron ini dapat difungsikan untuk mudah tidaknya atom dalam menarik elektron. Artinya semakin besar afinitas elektron yang dimiliki atom itu menunjukan bahwa atom itu mudah nenarik elektron dari luar dan membentuk ion negatif (anion)
Rumus Afinitas Elektron
Afinitas elektron yang terdapat suatu unsur menjadi suatu ukuran kecenderungan unsur tersebut untuk bertindak sebagai zat pengoksidasi. Zat pengoksidasi itu sendiri dalam reaksi redoks merupakan zat yang berperan sebagai akseptor atau penerima elektron.
Hal ini sangat berkaitan dengan sifat kimia dan sifat dari ikatan yang dibentuk oleh suatu atom dengan atom lain ketika membentuk molekul. Secara umum rumus reaksi yang terjadi ketika suatu atom menerima elektron dapat digambarkan sebagai berikut.
X + e– → X– + Energi
Hal ini juga sama atau setara dengan pelepasan elektron dari ion negatif menjadi atom yang bermuatan netral.
X– → X + e–
Dalam reaksi tersebut, X merepresentasikan atom yang bermuatan netral sedangkan e– merupakan elektron yang diberikan kepada atom X. Ketika terjadi reaksi, X menerima sebuah elektron sehingga X akan menjadi bermuatan negatif (X–) dan pada kondisi tersebut dihasilkan sejumlah energi tertentu.
Energi suatu atom terdsebut didapatkan ketika atom kehilangan ataupun memperoleh energi melalui reaksi kimia yang menyebabkan hilang atau bertambahnya elektron. Reaksi kimia yang melepaskan energi disebut dengan reaksi eksotermik sedangkan reaksi kimia yang menyerap energi dari luar disebut dengan reaksi endotermik. Energi dari reaksi eksotermik dituliskan dalam bentuk negatif atau diberi tanda negatif, sedangkan dalam reaksi endotermik energi diberi tanda positif.
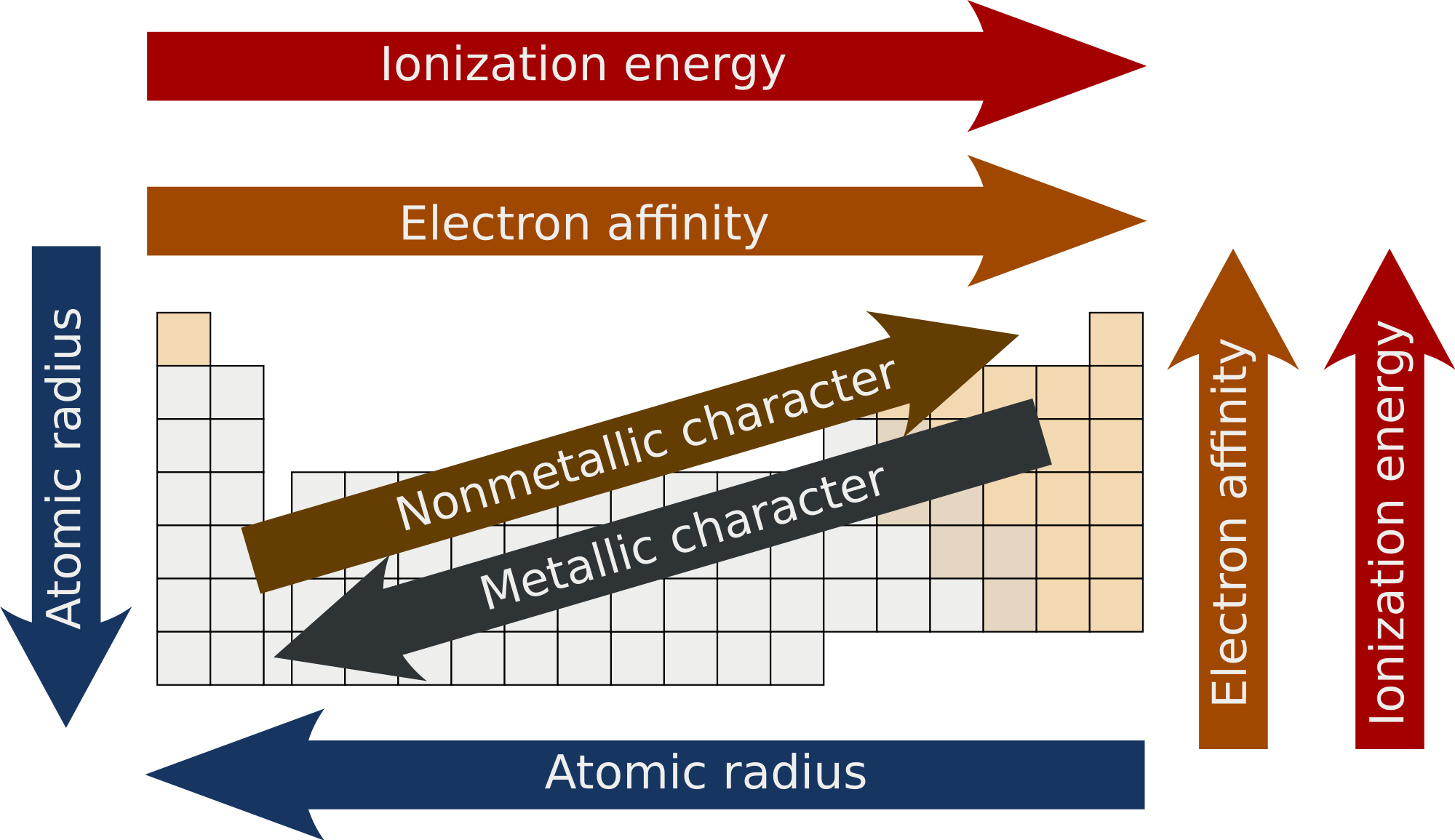
Afinitas elektron ditunjukkan dengan simbol EA dan biasanya dinyatakan dalam satuan kJ/mol. Dalam tabel periodik, afinitas elektron dapat mengikuti tren tabel periodik tersebut. Dalam satu golongan, afinitas elektron meningkat dari atas ke bawah.
Dalam satu periode, afinitas elektron juga meningkat dari kiri ke kanan. Nilai dari afinitas elektron bisa positif atau negatif tergantung dari jenis reaksi apakah eksoterm atau endoterm.
Cara Menentukan Afinitas Elektron
Untuk menentukan afinitas elektron, kita dapat menggunakan bantuan tabel sistem periodik unsur dimana pada tabel tersebut terdapat daftar unsur kimia yang telah disusun berdasarkan Mendeleev dan mengikuti tren yang ada. Dalam sistem periodik unsur, kita dapat memprediksi nilai afinitas elektron mengikuti tren pada sistem periodik unsur tersebut;
- Dalam satu golongan (kolom pada tabel periodik) nilai afinitas elektron akan semakin besar dari atas ke bawah golongan unsur.
- Dalam satu periode (baris pada tabel periodik) nilai afinitas elektron akan semakin besar dari kiri ke kanan periode unsur. Namun terdapat pengecualian pada gas mulia pada kolom terakhir tabel periodik dimana masing masing unsur pada gas mulia memiliki kulit elektron valensi yang terisi penuh sehingga sudah cukup stabil dan afinitas elektronnya mendekati nol atau sangat kecil dan tidak mengikuti tren.
Unsur non logam juga biasanya cenderung memiliki nilai afinitas elektron yang lebih tinggi daripada unsur logam. Salah satu unsur yang sangat besar energinya dalam menarik elektron yaitu klorin (Cl), sedangkan unsur yang paling lemah dalam menarik elektron adalah merkuri (Hg).
Pada dasarnya afinitas elektron lebih sulit diprediksi dalam molekul karena struktur elektroniknya yang sangat rumit dibandingkan dalam atom.
Jenis Afinitas Elektron
Adapun untuk beragam macam-macam dalam afinitas elektron ini antara lain;
-
Afinitas Elektron Pertama
Afinitas elektron terkait dengan pembentukan ion negatif dan penggunaannya hampir selalu terbatas pada unsur golongan 16 dan 17 dalam tabel periodik. Afinitas elektron pertama merupakan energi yang dilepaskan ketika 1 mol atom gas memperoleh elektron untuk membentuk 1 mol ion gas dengan muatan -1.
Dapat juga didefinisikan sebagai energi yang dilepaskan per mol X ketika perubahan terjadi. Afinitas elektron pertama ini memiliki nilai negatif. Sebagai contoh yaitu afinitas elektron pertama dari klorin adalah -349 kJ/mol dengan tanda negatif yang menunjukkan sebagai terjadinya pelepasan energi.
Ketika elektron ditambahkan ke dalam unsur logam, maka diperlukan energi untuk mendapatkan elektron tersebut (reaksi endotermik).
Oleh karena itu, unsur logam cenderung memiliki peluang lebih kecil untuk menerima elektron karena unsur logam justru lebih mudah mengalami kehilangan elektron pada valensinya karena inti logam tidak memiliki tarikan yang kuat pada elektron dan cenderung lebih mudah membentuk kation daripada membentuk ion negatif (anion). Dengan demikian, logam dikatakan memiliki afinitas elektron yang sangat rendah.
Ketika unsur non-logam memperoleh elektron, maka terjadi perubahan energi negatif yang berarti bahwa energi telah dilepas untuk menerima elektron (eksotermik). Unsur non logam memiliki afinitas elektron yang lebih besar daripada unsur logam.
Pertama yaitu karena unsur non logam memiliki elektron valensi yang lebih banyak daripada logam sehingga lebih mudah untuk mendapatkan elektron untuk memenuhi oktet yang stabil.
Kedua yaitu karena kulit elektron valensi pada unsur non logam lebih dekat dengan inti sehingga tarikan dari inti terhadap elektron cenderung lebih kuat untuk menjaga elektron yang lepas.
-
Afinitas Elektron Kedua
Afinitas elektron kedua adalah energi yang dibutuhkan dari atom untuk menambahkan elektron ke dalam setiap ion yang bermuatan -1 dalam 1 mol unsur gas. Ketika telah terjadi penerimaan elektron pertama, maka suatu unsur gas netral akan menjadi bermuatan -1.
Setelah itu, dapat terjadi kembali pemberian elektron sehingga ion gas tersebut akan menerima sebuah elektron dan muatannya akan menjadi -2. Energi yang dibutuhkan dalam penerimaan elektron kedua tersebut didefinisikan sebagai afinitas elektron kedua.
X– + e– → X2-
Dalam peristiwa ini, energi tidak dilepaskan melainkan dibutuhkan sehingga tanda energinya yaitu positif atau endoterm. Kebutuhan energi tersebut digunakan untuk memaksa elektron menjadi ion yang pada dasarnya sudah bermuatan negatif.
Umumnya energi yang dibutuhkan cukup besar karena elektron dipaksa masuk ke dalam ruang kecil yang sudah padat akan elektron sehingga akan sangat sulit jika dilakukan dengan energi rendah.
Contoh Soal Afinitas Elektron dan Jawaban
Sebagai upaya memperjelas tentang materi afinitas elektron, berikut adalah contoh soal dan pembahasannya secara lengkap. Antara lain;
- Tentukan atom mana yang memiliki afinitas elektron paling besar!
a. F
b. Cl
c. Br
d. I
Jawab : d. iodin (karena dalam satu golongan, afinitas elektron meningkat dari atas ke bawah)
- Atom manakah yang memiliki afinitas elektron paling rendah?
a. Mg
b. O
c. S
d. Br
Jawab : a. magnesium (karena magnesium merupakan atom logam dimana logam memiliki afinitas elektron yang cenderung rendah)
- Dari pernyataan berikut, manakah pernyataan yang tepat?
a. Semakin besar afinitas elektron, maka suatu atom cenderung lebih mudah melepaskan elektron
b. Semakin kecil afinitas elektron, maka suatu atom cenderung lebih susah menerima elektron
c. Dalam satu periode, afinitas elektron berkurang dari kiri ke kanan
d. Afinitas elektron paling besar terdapat dalam atom logam
Jawaban : b. Semakin kecil afinitas elektron, maka suatu atom cenderung lebih susah menerima elektron
Dari penjelasan yang dikemukakan, dapatlah dikatakan bahwa afinitas elektron hanya berlaku untuk atom dan molekul gas karena tingkat energi elektron dari fase cair dan padatan diubah oleh interaksi dengan atom atau molekul lain.
Meski demikian, afinitas elektron memiliki manfaat yang sangat banyak dalam kimia. Salah satunya adanya afinitas elektron digunakan untuk mengukur kekerasan kimia, seperti ukuran seberapa asam dan basa lewis yang terpolarisasi. Afinitas elektron juga digunakan untuk memprediksi nilai potensial kimia elektronik dalam elektrokimia.
Dimana penggunaan lain dari afinitas elektron yang biasa dilakukan adalah untuk menentukan apakah suatu atom atau molekul akan bertindak sebagai akseptor elektron atau donor elektron dalam suatu reaksi dan untuk memprediksi apakah dua reaktan akan saling bereaksi dalam reaksi redoks.
Nah, demikianlah tadi serangkaian artikel yang bisa kami tuliskan kepada segenap pembaca terkait dengan pengertian afinitas elektron menurut para ahli, rumus penghitungan, cara menentukan, jenis, contoh soal dan pembahasannya.



