 Entalpi bisa dikatakan menjadi bagian dari termokimia dimana dalam cabang penerapan ilmu kimia ini membahas lebih detail mengenai energi, panas, dan perubahan yang terjadi pada persitiwa secara kimia. Dalam kimia, entalpi membahas mengenai panas yang dihasilkan ataupun dibutuhkan dalam suatu peristiwa kimia.
Entalpi bisa dikatakan menjadi bagian dari termokimia dimana dalam cabang penerapan ilmu kimia ini membahas lebih detail mengenai energi, panas, dan perubahan yang terjadi pada persitiwa secara kimia. Dalam kimia, entalpi membahas mengenai panas yang dihasilkan ataupun dibutuhkan dalam suatu peristiwa kimia.
Hal ini juga berkaitan dengan definisi reaksi kimia yang terjadi seperti dalam pembentukan ikatan baru pada suatu senyawa kimia dimana proses tersebut dapat berlangsung secara eksoterm dengan melepaskan sejumlah energi tertentu ataupun sebaliknya proses pemecahan ikatan dalam suatu senyawa yang menyerap energi tertentu.
Entalpi
Diakui ataupun tidak, pada umumnya nilai entalpi ditentukan untuk pembentukan ataupun pemecahan jenis ikatan tertentu telah diketahui secara eksperimen sehingga hal ini dapat digunakan dalam memprediksi energi yang dihasilkan atau dibutuhkan dalam suatu reaksi. Entalpi ini disebut sebagai nilai entalpi reaksi.
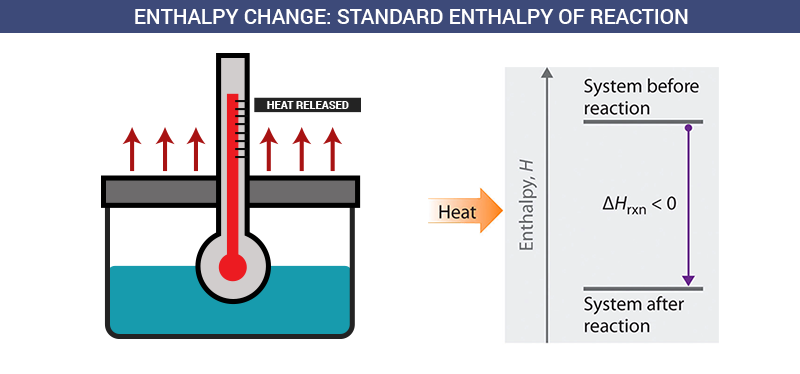
Sebelum belajar lebih lanjut mengenai entalpi, sebaiknya kita terlebih dahulu mengingat mengenai perubahan reaksi eksoterm dan reaksi endoterm. Dalam kimia, eksoterm adalah perubahan yang terjadi dengan menghasilkan sejumlah panas dan energi tertentu.
Pada umumnya, perubahan eksoterm akan dituliskan dengan tanda negatif yang mewakili sejumlah energi yang dilepaskan pada proses tersebut. Sedangkan endoterm adalah perubahan yang terjadi dengan menyerap sejumlah panas dan energi tertentu. Endoterm akan dituliskan dengan tanda positif untuk mewakili jumlah energi yang dibutuhkan dalam prosesnya.
Pengertian Entalpi
Entalpi adalah jumlah panas yang terlibat dalam suatu proses kimia seperti halnya reaksi kimia dimana panas tersebut dapat berupa panas yang dilepaskan ataupun panas yang dibutuhkan. Entalpi dilambangkan dengan simbol huruf H namun pada umumnya entalpi disajikan dalam bentuk perubahan entalpi sehingga dituliskan sebagai H. Entalpi juga dapat didefinisikan sebagai jumlah total dari energi dalam dengan tekanan dan volumenya.
Terjadinya perubahan kimia dalam suatu reaksi dapat berupa pembentukan ikatan kimia baru ataupun pemecahan ikatan kimia yang ada pada suatu senyawa. Peristiwa itu dapat melibatkan penyerapan ataupun pelepasan energi untuk terjadinya perubahan tersebut.
Dalam hal ini, sistem dan lingkungan juga akan terlibat dalam perpindahan energi tersebut. Sistem dalam hal ini merupakan objek yang mengalami reaksi sedangkan lingkungan berupa hal lain di sekitar sistem yang berinteraksi terhadap sistem tersebut.
Dalam pembentukan jenis ikatan kimia pada suatu senyawa, perubahan entalpi akan bernilai negatif yang berarti ketika terjadinya hal tersebut akan dilepaskan sejumlah panas tertentu. Sedangkan dalam pemecahan ikatan, perubahan entalpi akan bernilai positif yang menandakan bahwa proses tersebut membutuhkan sejumlah energi untuk dapat berlangsung.
Jenis Entalpi
Perubahan kimia dapat terjadi melalui beberapa hal seperti reaksi kimia, penguapan, pelarutan dan lain lain. Bahkan reaksi kimia pun juga terdiri dari beberapa jenis reaksi kimia yang berbeda. Dengan definisinya dimana entalpi terlibat dalam perubahan kimia, maka hal itu menyebabkan entalpi ini dapat terjadi dalam beberapa jenis perubahan tersebut.
Dalam kimia, jenis perubahan kimia itu akan mempengaruhi jenis entalpi yang terlibat didalamnya. Berikut ini adalah beberapa jenis entalpi yang ada saat ini.
-
Entalpi Reaksi (Hr)
Entalpi reaksi merupakan jenis entalpi yang paling umum dan paling sering digunakan karena jenis entalpi ini merupakan panas yang terlibat dalam perubahan secara reaksi kimia. Reaksi yang dimaksud dalam entalpi ini adalah reaksi secara umum sehingga tidak terkhusus untuk jenis reaksi tertentu.
Contoh entalpi reaksi yaitu pada reaksi antara aluminium dengan besi oksida.
2 Al(s) + Fe2O3(s) Al2O3(s) + 2 Fe(s) Hr = -851 kJ
-
Entalpi Pembentukan (Hf)
Entalpi pembentukan merupakan panas yang terlibat dalam pembentukan satu mol senyawa tertentu dari reaktan. Pada umumnya reaksi kimia akan menghasilkan pembentukan produk senyawa baru dimana hal ini akan mengakibatkan perubahan entalpi pembentukan. Jenis entalpi ini ditambahkan huruf f yang merupakan singkatan dari formation atau pembentukan.
Contoh dari entalpi pembentukan adalah reaksi pembentukan natrium klorida dari logam natrium dan gas klorin.
Na(s) + ½ Cl2(g) NaCl (s) Hf = -411.1 kJ
-
Entalpi Pengurahian (Hd)
Selain pembentukan, terdapat juga entalpi penguraian dimana definisinya merupakan panas yang terlibat dalam penguraian satu senyawa menjadi dua atau lebih senyawa lain atau proses pemecahan suatu senyawa kimia. Peristiwa ini merupakan kebalikan dari reaksi pembentukan.
Contohnya yaitu penguraian gas CO2 menjadi karbon dan oksigen dimana akan menghasilkan entalpi positif yang berarti endoterm atau membutuhkan energi tertentu untuk terjadinya reaksi ini.
CO2(g) C(s) + O2(g) Hd = +110.5 kJ
-
Entalpi Pembakaran (Hc)
Entalpi pembakaran adalah panas yang terlibat dalam reaksi kimia dimana 1 mol senyawa tertentu bereaksi dengan oksigen atau mengalami pembakaran. Reaksi pembakaran juga disebut dengan oksidasi karena senyawa akan bereaksi dengan oksigen menghasilkan air dan karbondioksida jika senyawa itu merupakan hidrokarbon.
Reaksi ini akan menghasilkan panas pembakaran negatif atau eksoterm dimana panas akan dilepaskan dari sistem ke lingkungan pada perubahan yang terjadi. Contohnya yaitu pada reaksi pembakaran gas propana.
C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(g) Hc = -108 kJ
-
Entalpi Penetralan (Hn)
Entalpi penetralan atau netralisasi merupakan perubahan panas yang terlibat dalam reaksi penetralan satu mol senyawa asam tertentu dengan senyawa basa lain dengan ekuivalen. Seperti yang kita ketahui bahwa reaksi antara asam dan basa yang ekuivalen akan menghasilkan penetralan dimana sifat asam dan basa akan saling menetralkan menghasilkan larutan yang bersifat netral.
Contoh entalpi penetralan yaitu pada reaksi HCl dan NaOH.
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l) Hn = -13.68 kJ
-
Entalpi Peleburan (Hfus)
Entalpi peleburan merupakan nilai entalpi atau panas yang berubah dalam peleburan satu mol senyawa tertentu. Dalam sifat fisiknya, setiap zat dikenal memiliki titik lebur tertentu dimana ketika tercapai suhu titik leburnya maka zat tersebut akan mengalami proses peleburan yakni perubahan wujud padat menjadi cair.
Proses ini umumnya memerlukan energi panas tertentu sehingga nilai entalpinya positif atau endoterm.
C2H6O(s) C2H6O(l) Hfus = + 5.0 kJ
-
Entalpi Penguapan (Hvap)
Hampir sama seperti entalpi peleburan, entalpi penguapan juga merupakan panas yang terlibat dalam penguapan satu mol senyawa tertentu.
Peristiwa ini sebenarnya tidak terjadi secara kimia, melainkan secara fisika karena hanya terjadi perubahan wujud tanpa perubahan struktur kimianya. Namun proses ini juga melibatkan sejumlah energi dan panas tertentu sehingga memiliki nilai entalpi.
Contohnya yaitu penguapain air dalam bentuk cair menjadi bentuk uap dimana proses ini berlangsung secara endoterm.
H2O(l) H2O(g) Hvap = +40.7 kJ
Rumus dan Cara Menghitung Entalpi
Sesuai definisinya entalpi dapat dirumuskan sebagai berikut:
H = U + PV
Dimana H merupakan entalpi, U merupakan energi dalam, P adalah tekanan dan V adalah volume. Entalpi pada umumnya tidak dapat dihitung secara individu sama seperti entropi, melainkan yang dapat dihitung yaitu perubahannya.
Sehingga untuk perubahan entalpi, dapat dihitung dengan menggunakan persamaan berikut:
H = U + P V
Contoh Soal Entalpi dan Jawabannya
Berikut ini adalah kumpulan soal dan pembahasan secara lengkap terkait dengan entalpi dalam ilmu kimia, antara lain adalah sebagai berikut;
1). Ketika 0.05 mol larutan HCl bereaksi dengan 0.05 mol larutan NaOH menghasilkan 0.05 mol larutan NaCl, dihasilkan panas sejumlah 2.9 kJ. Tentukan nilai perubahan entalpi untuk penetralan jika satu mol asam yang bereaksi dengan kondisi tersebut !
0.05 HCl(aq) + 0.05 NaOH(aq) 0.05 NaCl(aq) + 0.05 H2O(l) Hn = -2.9 kJ
Dalam hal ini jumlah yang bereaksi untuk tiap senyawa adalah 0.05 mol, maka untuk 1 mol senyawa asam yang bereaksi, nilai perubahan entalpinya yaitu sebagai berikut:
Delta H = x -2.9 kJ = -58 kJ
Maka ketika 1 mol HCl direaksikan dengan 1 mol NaOH, nilai perubahan entalpi penetralan yang menyertainya adalah -58 kJ.
Dari bahasan, dapatlah dikatakan bahwa sama seperti entropi, proses yang terjadi dengan adanya entalpi juga melibatkan terjadinya perubahan kimia. Dimana dengan adanya perubahan kimia tersebut akan menghasilkan perubahan energi serta panas dari sistem maupun lingkungan.
Dalam ilmu kimia, entalpi banyak digunakan dalam memprediksi dan mendesain suatu reaksi karena dengan mengetahui nilai entalpinya maka kita akan mengetahui jumlah energi yang dihasilkan dari suatu reaksi ataupun dibutuhkan dalam suatu reaksi kimia tertentu. Hal ini akan sangat berguna dalam efisiensi reaksi terutama jika reaksi tersebut akan diaplikasikan dalam skala besar atau dalam industri.
Nah, itulah tadi serangkain artikel yang sudah kami selesaikan secara lengkap kepada segenap pembaca terkait dengan pengertian entalpi, macam, rumus, contoh soal dan jawabannya. Semoga melalui materi ini bisa memberikan wawasan serta menambah pengetahuan. Trimakasih,


